题目内容
(1)某温度时,水的离子积KW=1×10-13,则该温度 25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10 mol/L,则该溶液的pH可能为 。
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和。此溶液中各种离子的浓度由大到小的排列顺序是: 。
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和。此溶液中各种离子的浓度由大到小的排列顺序是: 。
(1)> 3或10
(2)c(Na+)>c(SO42-)>c(H+)=c(OH-)
(2)c(Na+)>c(SO42-)>c(H+)=c(OH-)
(1)KW随温度升高而增大,10-13>10-14(25℃时),故该温度高于25℃。当溶液显碱性时pH=10,当溶液显酸性时c(H+)=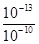 =10-3 mol/L,pH=3。
=10-3 mol/L,pH=3。
(2)Na2SO4溶液中离子浓度关系为:c(Na+)=2c(SO42-),而溶液呈中性,c(H+)=c(OH-)。
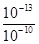 =10-3 mol/L,pH=3。
=10-3 mol/L,pH=3。(2)Na2SO4溶液中离子浓度关系为:c(Na+)=2c(SO42-),而溶液呈中性,c(H+)=c(OH-)。

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目

 与上述混合溶液中
与上述混合溶液中 相等
相等