题目内容
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定:①用 式滴定管盛装c mol/L盐酸标准液。如图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中,此时滴定管中液体的体积 mL。
②下表是4种常见指示剂的变色范围:

该实验应选用 作指示剂;
③有关数据记录如下:
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)c = 。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
A.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ;
B.读数时,若滴定前仰视,滴定后俯视,则会使测定结果 ;
C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 ;
D.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果 。
(1)滴定:①用 式滴定管盛装c mol/L盐酸标准液。如图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中,此时滴定管中液体的体积 mL。
②下表是4种常见指示剂的变色范围:

| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0—8.0 | 3.1—4.4 | 4.4—6.2 | 8.2—10.0 |
该实验应选用 作指示剂;
③有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | | | |
| 3 | V | 6.00 | 31.35 | 25.35 |
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)c = 。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
A.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ;
B.读数时,若滴定前仰视,滴定后俯视,则会使测定结果 ;
C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 ;
D.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果 。
(1)①酸 24.60 大于25.10 ②酚酞
(2)
(3)无影响 偏低 偏高 偏低
(2)

(3)无影响 偏低 偏高 偏低
试题分析:(1)酸性溶液或氧化性的物质的溶液用酸式滴定管;用去的标准酸溶液的体积为:24.90-0.30=24.60ml.由于使用的是50 mL滴定管,所以此时滴定管中带有刻度的部分溶液的体积为50 mL-24.90=25.10ml。在滴定管下边无刻度的部分还有液体,此时滴定管中液体的体积大于25.10ml. ②石蕊颜色变化不明显,所以一般不做酸碱滴定的指示剂。用酚酞或甲基橙作指示剂。由于甲基橙的变色范围是3.1—4.4,酚酞的变色范围是8.2—10.0。为了减少实验误差,要用酚酞相对更精确。(2)三次滴定消耗的标准HCl的体积分别是25.30ml、24.60ml、25.35ml。由于24.60ml相对误差较大。舍去。因此消耗的标准酸溶液的体积为(25.30ml+25.35ml)÷2=25.325ml..根据酸碱恰好中和时的物质的量相等 ,可得c(碱)=
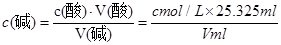 。(3)A.若滴定前用蒸馏水冲洗锥形瓶,由于待测的碱溶液中的溶质的质量及物质的量没有变化,所以对测定结果无影响。B.读数时,若滴定前仰视,读数偏大;滴定后俯视,读数偏小。则消耗的标准酸溶液的体积会偏小。因此以此为标准计算的待测溶液的浓度就偏低。C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则消耗的标准酸溶液体积偏大,以此为标准计算的待测溶液的浓度就偏高。D.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则消耗的标准酸溶液的体积偏少,会使测定结果偏低。
。(3)A.若滴定前用蒸馏水冲洗锥形瓶,由于待测的碱溶液中的溶质的质量及物质的量没有变化,所以对测定结果无影响。B.读数时,若滴定前仰视,读数偏大;滴定后俯视,读数偏小。则消耗的标准酸溶液的体积会偏小。因此以此为标准计算的待测溶液的浓度就偏低。C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则消耗的标准酸溶液体积偏大,以此为标准计算的待测溶液的浓度就偏高。D.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则消耗的标准酸溶液的体积偏少,会使测定结果偏低。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 +c(Z-)+c(OH-)
+c(Z-)+c(OH-)
 CH4(g)+O2(g)=
CH4(g)+O2(g)= CO2(g)+H2O(l)ΔH=-890 kJ/mol
CO2(g)+H2O(l)ΔH=-890 kJ/mol