题目内容
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式: 。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
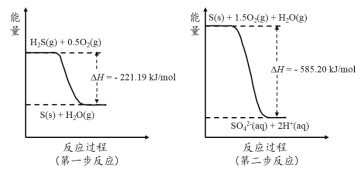
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
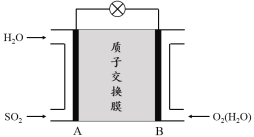
① 质子的流动方向为 (“从A到B”或“从B到A”)。
② 负极的电极反应式为 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
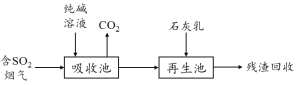
用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是 。
若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
【答案】(1)SO2+H2O![]() H2SO3;H2SO3
H2SO3;H2SO3![]() H++HSO3-
H++HSO3-
(2)H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)ΔH=-806.39kJ·mol-1
(3)①从A到B(1分)②SO2–2e-+2H2O==SO42-+4H+
(4)①H2O+2SO2+CO32-=2HSO3-+CO2↑②NaOH
【解析】
试题分析:(1)高湿条件下,大气中SO2转化为HSO3-的方程式为SO2 + H2O![]() H2SO3;H2SO3
H2SO3;H2SO3![]() H+ + HSO3-;
H+ + HSO3-;
(2)根据图像有:①H2S(g)+![]() O2(g)=S(s)+H2O(g) ΔH=-221.19kJ/mol,②S(s)+
O2(g)=S(s)+H2O(g) ΔH=-221.19kJ/mol,②S(s)+![]() O2(g)= SO42-(aq) +2H+(aq) ΔH =-585.20kJ/mol,将①+②,得:H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ΔH=-221.19kJ/mol+(-585.20kJ/mol)= -806.39 kJ/mol;
O2(g)= SO42-(aq) +2H+(aq) ΔH =-585.20kJ/mol,将①+②,得:H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ΔH=-221.19kJ/mol+(-585.20kJ/mol)= -806.39 kJ/mol;
(3)①根据图示,A为燃料电池的负极,B为燃料电池的正极,在原电池电解液中,正电荷由负极向正极移动,即从A到B,故答案为:从A到B;
② 负极发生氧化反应,二氧化硫被氧化为硫酸根离子,电极反应式为SO2 – 2e- + 2H2O=SO42- + 4H+;
(4)① 碳酸钠溶液吸收SO2生成亚硫酸氢钠和二氧化碳气体,反应的离子方程式为H2O + 2SO2 + CO32- =2HSO3- + CO2↑。② 氢氧化钙在吸收池中与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,其中氢氧化钠可以吸收SO2。

【题目】下列各组元素中,在生物体内含量极少,但对维持生物体正常活动必不可少的一组是( )
A. Fe、Mn、Zn、Mg B. Zn、Cu、Mg、Ca
C. Zn、Cu、B、Mn D. S、Mn、Cu、Mo
【题目】下列有关实验的操作正确的是( )
实验 | 操作 | |
A. | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
B. | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
C. | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
D. | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |