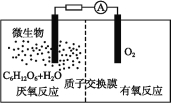
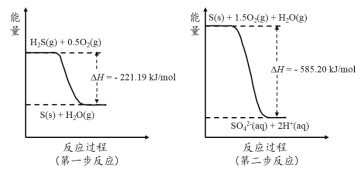
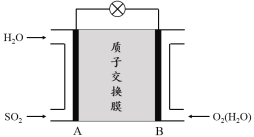
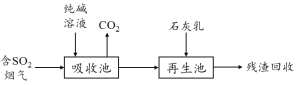
题目内容
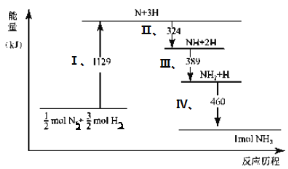
【题目】N2(g)与H2(g)在铁催化剂表面经历如右过程生成NH3(g):
下列说法正确的是( )
A.Ⅰ中1129KJ为该反应过程的活化能
B.N2(g)+3H2(g)![]() 2NH3(g) ΔH=2(324+389+460-1129)kJ/mol
2NH3(g) ΔH=2(324+389+460-1129)kJ/mol
C.Ⅱ、Ⅲ、Ⅳ均为放热过程
D.N2(g)+3H2(g)![]() 2NH3(g)ΔH>0
2NH3(g)ΔH>0
【答案】C
【解析】
试题分析:A.活化能的单位为kJ/mol,故A错误;B.ΔH =反应物键能之和-生成物键能之和=-2(324+389+460-1129)kJ/mol,故B错误;C.图象中Ⅱ、Ⅲ、Ⅳ三个过程均是能量降低的变化,所以是放热过程,故C正确;D.由图可知最终反应物的能量高于生成物的能量,是放热反应,因此△H<0,N2(g)+3H2(g)2NH3(g)△H<0,故D错误;故选C。

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目