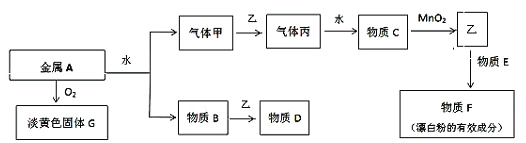
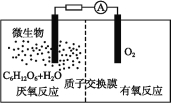
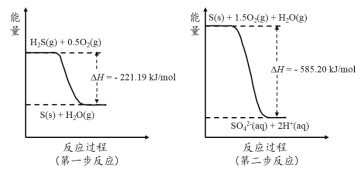
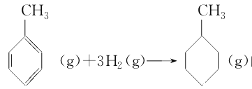题目内容
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
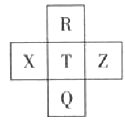
A. 非金属性:Z<T<X
B. R与Q的电子数相差26
C. 气态氢化物稳定性:R <T<Q
D. 最高价氧化物的水化物的酸性: X > T
【答案】B
【解析】试题分析:F 2与H 2在暗处剧烈化合并发生爆炸,生成HF,R为氟;由此可以推断X、T、Z、Q分别是硫、氯、氩、溴。Z、T、X分别是氩、氯、硫,稀有气体元素性质很稳定,同周期主族元素的非金属性随原子序数增大而递增,则非金属性:氩<硫<氯A项错误;R、Q分别是氟、溴,原子序数分别为9、35,氟和溴元素的原子序数相差35—9=26,由于元素的原子序数=原子的核外电子数,则氟和溴原子的电子数也相差26,B项正确;R、T、Q分别为氟、氯、溴,都是卤素,同主族非金属元素的非金属性随原子序数增大而减弱,则非金属性:氟>氯>溴,非金属性越强,气态氢化物越稳定,则HF>HCl>HBr或R>T>Q,C项错误;T、X分别是氯、硫,非金属性:氯>硫,非金属性越强,最高价氧化物的水化物酸性越强,则HClO 4的酸性比H2SO4强D项错误。

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
【题目】下列各项关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项 | 强电解质 | 弱电解质 | 非电解质 |
A | CaCO3 | HF | SO2 |
B | NaCl | NH3 | BaSO4 |
C | Fe | HCl | 蔗糖 |
D | HNO3 | Fe(OH)3 | MgO |
A. A B. B C. C D. D