题目内容
【题目】I.下列元素或化合物的性质变化顺序正确的是_______________
A.第一电离能:Cl>S>P>Si B.共价键的极性:HF>HCI>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
II.黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
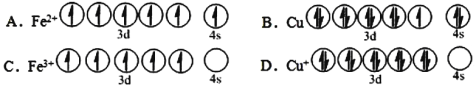
(1)CuFeS2中存在的化学键类型是________________。下列基态原子或离子的价层电子排布图正确的_____________。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是______,中心原子杂化类型为__________,属于_______(填“极性”或“非极性”)分子。
②X的沸点比水低的主要原因是____________________。
(3)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为_____,共价键的类型有_________。
(4)四方晶系CuFeS2晶胞结构如图所示。
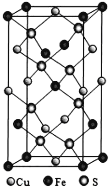
①Cu+的配位数为__________,S2-的配位数为____________。
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________gcm-3(列出计算式)。
【答案】BC 离子键 CD V形 sp3 极性 水分子间存在氢键 3 σ键和π键 4 4 ![]()
【解析】
I.A.当原子轨道填充为半满全满时,较稳定,P为半满结构;
B.共价键的极性与原子得失电子能力有关,得失电子能力差别越大,极性越强;
C.晶格能与离子半径有关,离子半径越大,晶格能越小;
D.热稳定性,同主族元素,越往下,越稳定;
II.(1)非金属与金属之间的化学键为离子键;电子排布应先排满低能轨道,再排满高能轨道;
(2)①H2S分子中价层电子有4对,孤对电子为![]() =2对,故构型是V形,中心原子杂化类型为sp3;非对称结构为极性分子。
=2对,故构型是V形,中心原子杂化类型为sp3;非对称结构为极性分子。
②水分子中存在氢键,使沸点升高。
(3)SO2中心原子的价层电子对数为![]() =3,以双键结合,故共价键类型为σ键和π键。
=3,以双键结合,故共价键类型为σ键和π键。
(4)①Cu+的配位数为6×![]() +4×
+4×![]() =4,S2-占据8个体心,有两个S,因此S2-的配位数为4。
=4,S2-占据8个体心,有两个S,因此S2-的配位数为4。
②根据![]() =
=![]() 计算晶体的密度。
计算晶体的密度。
I.A.当原子轨道填充为半满全满时,较稳定,P为半满结构,因此第一电离能最大,故不符合题意;
B.共价键的极性与原子得失电子能力有关,得失电子能力差别越大,极性越强,得电子能力,同主族元素从上到下依次减弱,故B符合题意;
C.晶格能与离子半径有关,离子半径越大,晶格能越小,离子半径,同主族元素从上到下依次增大,因此晶格能逐渐减小,故C符合题意;
D.热稳定性,同主族元素,越往下,越稳定,因此D不符合题意;
故答案选BC。
II.(1)CuFeS2中存在非金属与金属之间的化学键,为离子键;电子排布应先排满低能轨道,再排满高能轨道,因此,B不符合题意,而失去电子时,应先失去高能轨道电子,故CD符合题意。
故答案为CD。
(2)①臭鸡蛋气味的气体为硫化氢,分子中价层电子有4对,孤对电子为![]() =2对,故构型是V形,中心原子杂化类型为sp3,有孤对电子,为非对称结构,因此为极性分子。
=2对,故构型是V形,中心原子杂化类型为sp3,有孤对电子,为非对称结构,因此为极性分子。
②由于在水分子中,氧元素吸引电子能力极强,故水分子中存在氢键,沸点升高。
故答案为:V形 ;sp3 ;极性;水分子间存在氢键。
(3)SO2中心原子的价层电子对数为![]() =3,以双键结合,故共价键类型为σ键和π键。
=3,以双键结合,故共价键类型为σ键和π键。
故答案为:3;σ键和π键。
(4)①Cu+的配位数为6×![]() +4×
+4×![]() =4,S2-占据8个体心,有两个S,因此S2-的配位数为4。
=4,S2-占据8个体心,有两个S,因此S2-的配位数为4。
②根据![]() =
=![]() ,质量m=(4×64+4×56+8×32)/NA,体积V=0.524×0.524×1.032×10-21cm-3,
,质量m=(4×64+4×56+8×32)/NA,体积V=0.524×0.524×1.032×10-21cm-3,
所以,CuFeS2晶体的密度是![]() g/cm3。
g/cm3。
故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题:

(1)选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。为了得到干燥.纯净的CO2,产生的气流应依次通过盛有_________的洗气瓶(填试剂名称)。反应结束后,关闭弹簧夹,可观察到的现象是____________________________。不能用稀硫酸代替稀盐酸,其原因是______________________________。
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
步骤 | 现象 |
将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却 | 产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生 |
在集气瓶中加入适量蒸馏水,振荡.过滤 | 滤纸上留下黑色固体,滤液为无色溶液 |
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。
据此推断,白色物质的主要成分是________(填标号)。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是________________。
③本实验中金属钠与二氧化碳反应的化学方程式为_______________________。

