题目内容
【题目】降低大气中C02的含量及有效地开发利用CO2,已引起了全世界的普遍重视。
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1
CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1
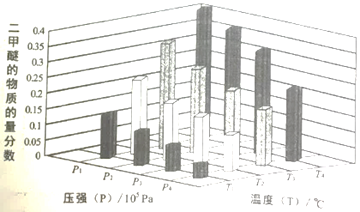
某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时、改变压强和温度,平衡体系中CH3OCH3(g)的物质分数变化情况如图所示,则p1______p2(填“>”“<”或“=”,下同)。若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1______K3,T1、P1时H2的平衡转化率为____________。
②在恒容密闭容器里按体积比为1:3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是______(填序号)。
A. 反应物的浓度增大 B. 混合气体的密度减小
C. 正反应速率小于逆反应速率 D. 氢气的转化率减小
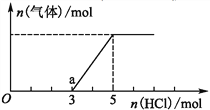
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:通入1mol HCl时,溶液中所含溶质的化学式_____________,a点溶液中各离子浓度由大到小的关系式为___________________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其![]() 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为![]() mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________mol·L-1.
mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________mol·L-1.
【答案】 > < 57.1% C Na2CO3、NaCl c(Na+)>c(Cl-)>c(HC03-)>c(OH-)>c(H+)>c(CO32-) ![]()
【解析】(1)①2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1,该反应为气体分子数减少的放热反应,所以平衡时,二甲醚的百分含量随温度升高而减少、随压强增大而增大,该反应的平衡常数随温度升高而减小。由图可知,在相同温度、p1和p2两种不同压强下,p1对应的二甲醚的百分含量较高,所以p1>p2;在相同压强、T1和T3两种不同温度下,T3对应的二甲醚的百分含量较高,所以,T1>T3,由于化学平衡常数只与温度有关,所以,若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1<K3。T1、P1时,若H2的平衡转化率为为
CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1,该反应为气体分子数减少的放热反应,所以平衡时,二甲醚的百分含量随温度升高而减少、随压强增大而增大,该反应的平衡常数随温度升高而减小。由图可知,在相同温度、p1和p2两种不同压强下,p1对应的二甲醚的百分含量较高,所以p1>p2;在相同压强、T1和T3两种不同温度下,T3对应的二甲醚的百分含量较高,所以,T1>T3,由于化学平衡常数只与温度有关,所以,若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1<K3。T1、P1时,若H2的平衡转化率为为![]() ,则H2的变化量为6.0
,则H2的变化量为6.0![]() ,CO2、CH3OCH3、H2O的变化量分别为2.0
,CO2、CH3OCH3、H2O的变化量分别为2.0![]() 、1.0
、1.0![]() 、3.0
、3.0![]() ,因为二甲醚的体积分数为0.1,所以
,因为二甲醚的体积分数为0.1,所以![]() ,解之得,H2的平衡转化率为57.1%。②在恒容密闭容器里按体积比为1:3充入二氧化碳和氢气,一定条件下反应达到平衡状。当改变反应的某一个条件后,A. 反应物的浓度增大,可能是增大了反应物的浓度(再加入少量的反应物)使平衡向正反应方向移动的结果,也可能是增大生成物浓度(或升高温度)使平衡向逆反应方向移动的结果; B. 混合气体的密度减小,有可能是减小反应物浓度使平衡逆向移动,也有可能是减小生成物浓度(如降低温度使部分水液化)使平衡正向移动的结果;C. 正反应速率小于逆反应速率,平衡一定向逆反应方向移动;D. 氢气的转化率减小,可能是增大氢气的浓度(再加入少量氢气)使平衡正向移动的结果,也可能是升高温度使平衡逆向移动的结果。综上所述,能说明平衡一定向逆反应方向移动的是C。
,解之得,H2的平衡转化率为57.1%。②在恒容密闭容器里按体积比为1:3充入二氧化碳和氢气,一定条件下反应达到平衡状。当改变反应的某一个条件后,A. 反应物的浓度增大,可能是增大了反应物的浓度(再加入少量的反应物)使平衡向正反应方向移动的结果,也可能是增大生成物浓度(或升高温度)使平衡向逆反应方向移动的结果; B. 混合气体的密度减小,有可能是减小反应物浓度使平衡逆向移动,也有可能是减小生成物浓度(如降低温度使部分水液化)使平衡正向移动的结果;C. 正反应速率小于逆反应速率,平衡一定向逆反应方向移动;D. 氢气的转化率减小,可能是增大氢气的浓度(再加入少量氢气)使平衡正向移动的结果,也可能是升高温度使平衡逆向移动的结果。综上所述,能说明平衡一定向逆反应方向移动的是C。
(2)由图可知,反应明显分为两个阶段,前后两个阶段所消耗的HCl的物持的量之比为3:2,说明原溶液中的溶质为碳酸钠和氢氧化钠,且两者物质的量之比为2:1,两者物质的量分别是2mol、1mol。通入1mol HCl时,氢氧化钠恰好反应完全,溶液中所含溶质为Na2CO3、NaCl。a点溶液中有3mol NaCl和1molNaHCO3,由于碳酸氢根离子的水解程度大于电离程度,所以,各离子浓度由大到小的关系式为c(Na+)>c(Cl-)>c(HC03-)>c(OH-)>c(H+)>c(CO32-)。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难容物质,其![]() 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为![]() mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为
mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为![]() mol·L-1.
mol·L-1.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:
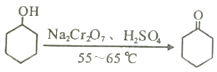
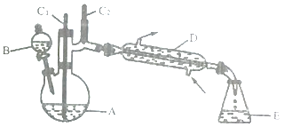
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的的名称是为__________________。
(2)酸性Na2Cr207溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①如何滴加酸性Na2Cr2O7溶液__________________________________;
②蒸馏不能分离环己酮和水的原因是_____________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏、除去乙醚后,收集151~156℃馏分
b. 水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c. 过滤
d. 往液体中加入NaCl固体至饱和,静置,分液
e. 加入无水MgSO4固体,除去有机物中少量的水
① 上述提纯步骤的正确顺序是______________________________;
② b中水层用乙醚萃取的目的是______________________________________;
③ 上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_____________,操作d中,加入NaCl固体的作用是______________________________。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环己酮的产率为______________。



