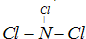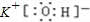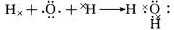题目内容
现有A、B、C、D、E五种短周期元素,已知他们的原子序数依次增大,元素A的原子只有一个电子层;又知元素A能分别与元素B、C、D形成电子总数相等的化合物分
子X、Y、Z,Y有刺激性气味,Z常温下为液态,元素E的单质的水溶液有漂白性。
请回答下列问题:
(1)元素E的单质的饱和溶液与石灰石反应后所得溶液的漂白性增强的原因是 ;
(2) 在锅炉水中加入C2A4,可以把锅炉表面的氧化铁还原为结构紧密的四氧化三铁保护层,C2A4 被氧化,且反应中无污染物生成,写出反应的化学方程式(不必配平) ,1 mol C2A4 参加反应转移电子的数目为 ,氧化产物的化学式为 ;
(3)化合物Y与元素C的最高正价氧化物的水化物按物质的量比为2:1完全反应后的水溶液呈 性(填“酸”“碱”或“中”),溶液中离子浓度由大到小的顺序为 ;
(4)用X、D2 和能传导O2-的的固体电解质组成的原电池中,负极的电极反应式为 。
(5)A、B、D三种元素可以形成最简式为B2A4D且有香味的有机物,该有机物在酸性条件下可以水解,生成含碳原子数相同的两种常见有机物,这两种有机物均可用作食品调味剂。则这种有香味的有机物在一定条件下水解的化学方程式是 。
1)在氯水中存在以下平衡Cl2 + H2O HCl + HClO(1分),CaCO3 与氯水中的HCl反应,使 c(H+)减小(1分),使上述平衡向右移动, HClO浓度增大(1分),故漂白性增强
(2)6Fe2O3+N2H4=4Fe3O4+N2↑+ 2H2O(2分),4NA(1分),N2(1分)
(3)碱(1分),c (NH4+)> c (NO3-)> c (OH-)> c (H+)(2分)
(4)CH4-8e-+4O2-= CO2 +2H2O (2分)
(5)CH3COOCH2CH3 + H2O CH3COOH + CH3CH2OH (2分)

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.