题目内容
现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构.已知:
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G
P
Q
M+P
④E和D是同主族元素,氢化物(H2E)常温下为气态.
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)A元素的原子结构示意图是 ;B2E的电子式为 .
(2)化合物X所含化学键类型有 .
(3)G气体的检验方法为 .
(4)写出F单质与E的氢化物反应的方程式并标明电子转移方向和数目 .
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同主族元素,氢化物(H2E)常温下为气态.
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)A元素的原子结构示意图是
(2)化合物X所含化学键类型有
(3)G气体的检验方法为
(4)写出F单质与E的氢化物反应的方程式并标明电子转移方向和数目
分析:①常温下,F的单质是一种有色气体,常用于杀菌、消毒,推断为Cl2;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,说明是两性氧化物判断为Al2O3;
③C的氢化物分子G是具有10电子的微粒,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,可以发生下列转化:G
P
Q
M+P
推断C为N元素,G为NH3,D为O元素P为NO,Q为NO2,M为HNO3;
④E和D是同主族元素,氢化物(H2E)常温下为气态.判断E为S;
⑤B和D为O可形成微粒个数比为1:1和2:1的离子化合物X和Y.结合A、B、C、D离子具有相同的电子层结构,判断B为Na;X为Na2O2,Y为Na2O,依据判断呈的物质回答.
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,说明是两性氧化物判断为Al2O3;
③C的氢化物分子G是具有10电子的微粒,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,可以发生下列转化:G
| D的单质 |
| D的单质 |
| H2O |
推断C为N元素,G为NH3,D为O元素P为NO,Q为NO2,M为HNO3;
④E和D是同主族元素,氢化物(H2E)常温下为气态.判断E为S;
⑤B和D为O可形成微粒个数比为1:1和2:1的离子化合物X和Y.结合A、B、C、D离子具有相同的电子层结构,判断B为Na;X为Na2O2,Y为Na2O,依据判断呈的物质回答.
解答:解:A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构;
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,推断为Cl2;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,说明是两性氧化物判断为Al2O3;A为Al元素;
③C的氢化物分子G是具有10电子的微粒,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,可以发生下列转化:G
P
Q
M+P
推断C为N元素,G为NH3,D为O元素P为NO,Q为NO2,M为HNO3;
④E和D是同主族元素,氢化物(H2E)常温下为气态.判断E为S;
⑤B和D为O可形成微粒个数比为1:1和2:1的离子化合物X和Y.结合A、B、C、D离子具有相同的电子层结构,判断B为Na;X为Na2O2,Y为Na2O;
(1)A元素为Al,原子结构示意图是: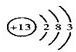 ;B2E为Na2S,硫化钠是离子化合物,硫化钠的电子式为:
;B2E为Na2S,硫化钠是离子化合物,硫化钠的电子式为: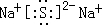 ,
,
故答案为: ;
;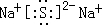 ;
;
(2)化合物X为Na2O2,所含化学键类型有:离子键、非极性共价键,故答案为:离子键、非极性共价键;
(3)G气体为NH3检验方法为:用湿润的红色石蕊试纸检验气体,若试纸变蓝证明气体为氨气,
故答案为:用湿润的红色石蕊试纸检验气体,若试纸变蓝证明气体为氨气;
(4)F单质为Cl2与E的氢化物为H2S反应的方程式为:H2S+Cl2=S+2HCl,标明电子转移方向和数目的化学方程式为: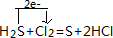 ,
,
故答案为: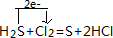 .
.
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,推断为Cl2;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,说明是两性氧化物判断为Al2O3;A为Al元素;
③C的氢化物分子G是具有10电子的微粒,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,可以发生下列转化:G
| D的单质 |
| D的单质 |
| H2O |
推断C为N元素,G为NH3,D为O元素P为NO,Q为NO2,M为HNO3;
④E和D是同主族元素,氢化物(H2E)常温下为气态.判断E为S;
⑤B和D为O可形成微粒个数比为1:1和2:1的离子化合物X和Y.结合A、B、C、D离子具有相同的电子层结构,判断B为Na;X为Na2O2,Y为Na2O;
(1)A元素为Al,原子结构示意图是:
 ;B2E为Na2S,硫化钠是离子化合物,硫化钠的电子式为:
;B2E为Na2S,硫化钠是离子化合物,硫化钠的电子式为: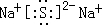 ,
,故答案为:
 ;
;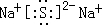 ;
;(2)化合物X为Na2O2,所含化学键类型有:离子键、非极性共价键,故答案为:离子键、非极性共价键;
(3)G气体为NH3检验方法为:用湿润的红色石蕊试纸检验气体,若试纸变蓝证明气体为氨气,
故答案为:用湿润的红色石蕊试纸检验气体,若试纸变蓝证明气体为氨气;
(4)F单质为Cl2与E的氢化物为H2S反应的方程式为:H2S+Cl2=S+2HCl,标明电子转移方向和数目的化学方程式为:
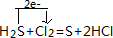 ,
,故答案为:
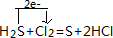 .
.点评:本题考查了物质转化关系分析,原子结构的判断应用,主要是原子结构的分析方法和元素判断,结构和性质的分析理解,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.






