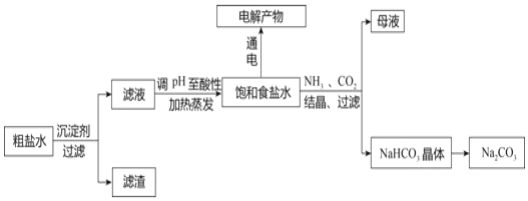
题目内容
【题目】工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。则下列说法不正确的是( )
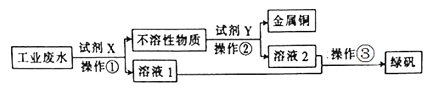
A.试剂X为铁粉
B.试剂Y为稀盐酸,操作②是过滤
C.操作③是:蒸发浓缩,冷却结晶,过滤
D.可用K3Fe(CN)6溶液来检验“溶液1”中的主要阳离子
【答案】B
【解析】
结合流程可知,加入铁粉,可置换出铜,同时生成硫酸亚铁,操作①为过滤,则溶液1中主要含硫酸亚铁,不溶性物质中含Cu、Fe,加入Y为![]() ,操作②为过滤,金属为Cu,溶液2主要含
,操作②为过滤,金属为Cu,溶液2主要含![]() ,蒸发、浓缩、结晶、过滤,可得到
,蒸发、浓缩、结晶、过滤,可得到![]() ,以此来解答。
,以此来解答。
结合流程可知,加入铁粉,可置换出铜,同时生成硫酸亚铁,操作①为过滤,则溶液1中主要含硫酸亚铁,不溶性物质中含Cu、Fe,加入Y为![]() ,操作②为过滤,金属为Cu,溶液2主要含
,操作②为过滤,金属为Cu,溶液2主要含![]() ,蒸发、浓缩、结晶、过滤,可得到
,蒸发、浓缩、结晶、过滤,可得到![]() ;
;
A.加入铁粉,铁置换出铜,可除去铜离子,则试剂X为铁粉,故A正确;
B.Y用于溶解铁粉,防止引入杂质,应加入稀硫酸,故B错误;
C.操作③是:蒸发浓缩,冷却结晶,过滤,故C正确;
D.溶液1中主要含硫酸亚铁,所以可用![]() 溶液来检验“溶液1”中的主要阳离子
溶液来检验“溶液1”中的主要阳离子![]() ,故D正确;
,故D正确;
故答案选B。

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目