题目内容
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
| A.氧化性Cr2O72->Fe3+>SO2 |
| B.Cr2O72-能将Na2SO3氧化成Na2SO4 |
| C.每有1 mol K2Cr2O7参加反应,转移电子的数目为3NA |
| D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.1 mol K2Cr2O7 |
C
试题分析:A、在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,所以根据反应SO2+2Fe3++2H2O=SO42-+2Fe2++4H+可知,Fe3+做氧化剂,SO42-为氧化产物,SO2为还原剂,所以氧化性:Fe3+>SO42->SO2。根据反应Cr2O2- 7+6Fe2++14H+=2Cr3++6Fe3++7H2O可知,Cr2O72-为氧化剂,Fe3+为氧化产物,所以氧化性是Cr2O72->Fe3+,因此氧化性强弱顺序是Cr2O72->Fe3+>SO2,A正确;B、Cr2O72-具有强氧化性,能把Na2SO3氧化成Na2SO4,B正确;C、反应中Cr元素的化合价从+6价降低到+3价,所以每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA,C不正确;D、6.72 L SO2(标准状况)的物质的量=6.72L÷22.4L/mol=0.3mol,反应中失去0.3mol×2=0.6mol电子。1mol K2Cr2O7在反应中得到6mol电子,所以若6.72 L SO2(标准状况)参加反应,则最终消耗0.1 mol K2Cr2O7,D正确,答案选C。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目

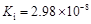
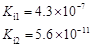
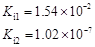
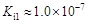 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O ,试配平上述化学方程式。
,试配平上述化学方程式。 KCl + MnCl2 + Cl2↑ + H2O
KCl + MnCl2 + Cl2↑ + H2O