��Ŀ����
ʵ������Ѹ���Ʊ������������������·�Ӧ��
KMnO4+ HCl KCl + MnCl2 + Cl2�� + H2O
KCl + MnCl2 + Cl2�� + H2O
��1������ƽ������ѧ����ʽ�����������á�˫���ŷ��� ��������ת�Ƶķ������Ŀ��
��2���÷�Ӧ������������ ��KMnO4���� ��Ӧ��
��3��HCl��������Ӧ����ʾ������������ ��
��4���ø�Ũ�����Ƶ��˱����560mlCl2,��������HClΪ mol����ҪKMnO4������ g��ת�Ƶ�����Ϊ ��
KMnO4+ HCl
 KCl + MnCl2 + Cl2�� + H2O
KCl + MnCl2 + Cl2�� + H2O ��1������ƽ������ѧ����ʽ�����������á�˫���ŷ��� ��������ת�Ƶķ������Ŀ��
��2���÷�Ӧ������������ ��KMnO4���� ��Ӧ��
��3��HCl��������Ӧ����ʾ������������ ��
| A�������� | B����ԭ�� | C������ | D������ |
��1��2 KMnO4+16 HCl =" 2" KCl + 2 MnCl2 + 5 Cl2�� + 8 H2O
��2��Cl2����ԭ ��3��BC ��4�� 0.05 mol 1.58g 0.05NA��3.01��1022
��2��Cl2����ԭ ��3��BC ��4�� 0.05 mol 1.58g 0.05NA��3.01��1022
�����������1����Ӧ��HCl��Cl2����Ԫ�ػ��ϼ���-1������Ϊ0�ۣ�������2�ۣ�KMnO4��MnCl2��MnԪ�ػ��ϼ���+7�۽���Ϊ+2�ۣ�������5�ۣ����ϼ�������С������Ϊ10����KMnO4ϵ��Ϊ2����Cl2ϵ��Ϊ5������MnԪ���غ��֪MnCl2ϵ��Ϊ2������KԪ���غ��֪KClϵ��Ϊ2������ClԪ���غ��֪HClϵ��Ϊ16������HԪ�ؿ�֪H2O��ϵ��Ϊ8����ƽ��ʽΪ��2KMnO4+16HCl�T2KCl+2MnCl2+5Cl2��+8 H2O���á�˫���ŷ�����������ת�Ƶķ������ĿΪ��
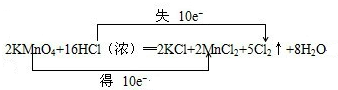 ��
����2����Ӧ��HCl��Cl2����Ԫ�ػ��ϼ���HCl��-1������ΪCl2��0�ۣ�Cl2�����������ӦKMnO4��MnCl2��MnԪ�ػ��ϼ���+7�۽���Ϊ+2�ۣ�KMnO4����������������ԭ��Ӧ��
��3���ɷ���ʽ��֪����Ӧ��KCl��Cl2�к�����Ԫ�أ�KCl����Ԫ�ػ��ϼ�Ϊ-1�ۣ�Cl2����Ԫ�ػ��ϼ�Ϊ0�ۣ�˵����Ӧ��HCl�������ԡ���ԭ�ԣ�ѡBC��
��4����״����560mlCl2�����ʵ���Ϊ0.025mol����������HCl����Cl2��������Ԫ���غ��֪��������HClΪ0.025mol��2=0.05mol������2KMnO4+16HCl�T2KCl+2MnCl2+5Cl2��+8 H2O��֪������0.025molCl2����ҪKMnO4�����ʵ���Ϊ0.01mol������Ϊ0.01mol��158g/mol=1.58g����Ӧ��HCl��Cl2����Ԫ�ػ��ϼ���HCl��-1������ΪCl2��0�ۣ���ת�Ƶ������ʵ���Ϊ0.025mol��2=0.05mol��ת�Ƶ�����ĿΪ0.05mol��NAmol-1=0.05NA��

��ϰ��ϵ�д�
�����Ŀ
 CuSO4��SO2����2H2O�����ڸ÷�Ӧ������˵���в���ȷ����
CuSO4��SO2����2H2O�����ڸ÷�Ӧ������˵���в���ȷ���� ��������2mol/L����Һ����ȣ��������������к�ɫ�������ɢڲ����̼�����ζ������ ����Һ������ɫ���ݴ��ж�����˵����ȷ���ǣ� ��
��������2mol/L����Һ����ȣ��������������к�ɫ�������ɢڲ����̼�����ζ������ ����Һ������ɫ���ݴ��ж�����˵����ȷ���ǣ� �� 3HNCO��8HNCO+6NO2
3HNCO��8HNCO+6NO2