题目内容
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
| A.氧化性Cr2O72-> Fe3+>SO2 |
| B.能将Na2SO3氧化成Na2SO4 |
| C.每有1 mol K2Cr2O7参加反应,转移电子的数目为3NA |
| D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.1 mol K2Cr2O7 |
C
试题分析:A选项氧化剂大于氧化产物,可以推出Cr2O72-> Fe3+>SO2,正确。B选项最终生成Na2SO4 ,正确。C选项1 mol K2Cr2O7参加反应生成Cr3+,应转移电子的数目为6NA,错误。D选项
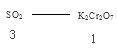 ,0.3molSO2应消耗0.1 mol K2Cr2O7
,0.3molSO2应消耗0.1 mol K2Cr2O7
练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
 -氧化性
-氧化性 在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )