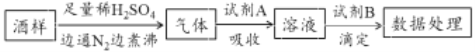
题目内容
【题目】砷(As)及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:
(1)砷是第四周期VA族元素。下列关于第VA族元素及其化合物的说法不正确的是_______(填序号)。
a.沸点:PH3<NH3
b.酸性:HNO3>H3AsO4
c.As的氧化物的水化物是强碱
d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理为:
①将含砷化合物转化为具有极强还原性的AsH3;
②AsH3与AgNO3溶液反应产生As2O3与另一种固体,该反应的离子方程式为_____________。
(3)砷及其化合物几乎都有毒,通常+3价砷化合物毒性强于+5价砷化合物。海产品中含有微量+5价砷化合物,食用海鲜后不能马上进食水果的原因是________________________________。
(4)砷酸(H3AsO4)可用于制造杀虫剂、药物。As2O3溶于稀硝酸中可得砷酸,此反应的化学方程式为________________________________。
(5)利用单质铁处理水体砷污染的原理为:单质铁在水体中被氧化腐蚀得到水合氧化铁[Fe(OH)3和FeOOH],吸附沉降砷的化合物。在其它条件一定时,调节水样的pH,得到除砷效率曲线如图所示。
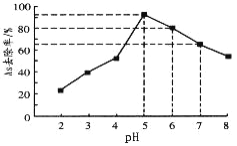
①请解释水样酸性较强时,除砷效率较低的原因是_____________________。
②国家饮用水标准规定水中砷的含量应低于0.05mg·L-1(1mg=1000μg)。某水样中含砷总浓度为100μg·L-1,若控制水样的pH=6,出水后的砷浓度_________________(填“能”或“否”)达到饮用水标准。
【答案】c 2AsH3+12Ag++3H2O=As2O3+12H++12Ag 水果中富含还原性物质(维生素C等),能将+5价的砷化物还原为毒性更大的+3价砷化物 3As2O3+4HNO3+7H2O=6H3AsO4+4NO![]() 酸性较强时,不易生成水合氧化铁,吸附能力下降,除砷效率降低 能
酸性较强时,不易生成水合氧化铁,吸附能力下降,除砷效率降低 能
【解析】
(1)根据元素周期律判断;
(2)②AsH3被氧化,且生成物中有另一种固体,则AgNO3中Ag+被还原为Ag,根据氧化还原配平原则配平即可;
(3)水果中含有大量还原性物质,+5价砷化物具有氧化性,能够与食物中还原性物质发生氧化还原反应生成毒性更大的+3价砷化物;
(4)As2O3中As为+3价。,H3AsO4中As为+5价,即As2O3与稀硝酸反应中As被氧化,稀硝酸被还原,配平即可;
(5)①根据单质铁处理水体砷污染的原理为:单质铁或在水体中被氧化腐蚀得到水合氧化铁,水合氧化铁能吸附沉降砷的化合物,结合水合氧化铁的组成分析;
②根据图可以看出:若控制水样的pH=6,则As的去除率为80%,此时水中剩余的As为20%;污水没有开始处理时,水中As的浓度为100μg/L,水样的pH=6时,水中剩余的As为100μg/L×20%=20μg/L=0.02mg/L,据此判断。
(1)As和N、P位于同一主族,且原子序数As>P>N,根据同主族元素从上到下非金属性逐渐减弱可知,非金属性N>P>As;
a.NH3分子间存在氢键,而PH3分子间不存在氢键,故沸点NH3>PH3,正确;
b.非金属性越强,其最高价氧化物对应的水化物酸性越强,故酸性:HNO3>H3AsO4,正确;
c.As为非金属元素,故其氧化物的水化物不可能都为强碱,错误;
d.同主族元素,从上到下电子层数增加,形成的简单离子电子层数逐渐增加,因此形成的简单离子半径逐渐增加,正确;
(2)②由上述分析可知,该反应的离子反应方程式为:2AsH3+12Ag++3H2O=As2O3+12H++12Ag;
(3)水果中含有大量还原性物质(如维生素C等),+5价砷化物具有氧化性,能够与食物中还原性物质发生氧化还原反应生成毒性更大的+3价砷化物;
(4)由题干信息可知,As2O3反应后化合价升高2,稀硝酸反应生成NO,其中N元素化合价降低3,根据氧化还原反应过程中得失电子守恒,可写出其方程式为:3As2O3+4HNO3+7H2O=6H3AsO4+4NO![]() ;
;
(5)①单质铁处理水体砷污染的原理为:单质铁或在水体中被氧化腐蚀得到水合氧化铁,水合氧化铁能吸附沉降砷的化合物,若水样酸性较强时,单质铁容易被腐蚀,不易生成水合氧化铁;
②由图可以看出:若控制水样的pH=6,则As的去除率为80%,此时水中剩余的As为20%;污水没有开始处理时,水中As的浓度为100μg/L,水样的pH=6时,水中剩余的As为100μg/L×20%=20μg/L=0.02mg/L<0.05mg/L,国家饮用水标准规定水中砷的含量应低于0.05mg/L,故出水后的砷浓度达到饮用水标准。

【题目】由下列实验及现象能推出相应结论的是
实验 | 现象 | 结论 | |
A | 将硝酸亚铁样品溶于稀硫酸,滴加KSCN溶液 | 溶液变为红色 | 硝酸亚铁样品已氧化变质 |
B | 向硅酸钠溶液中通入CO2 | 产生白色沉淀 | 非金属性:C>Si |
C | 向盛有FeS固体的烧杯中滴加盐酸,并产生气体通入溴水中 | 溴水褪色 | 还原性:S2->Br->Cl- |
D | 向无色溶液中滴入氯化钡溶液和稀硝酸 | 有白色沉淀产生 | 无色溶液中一定含有SO42-或SO32- |
A. AB. BC. CD. D