题目内容
16.在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是( )| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率高 | |
| C. | t1至t2时刻该反应的速率为3mol•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
分析 A、t3时刻达到了平衡状态,反应没有停止;
B、反应前A、B的浓度之比小于2:1,反应过程中消耗的A、B的浓度之比等于2:1,则转化率A的大于B;
C、反应速率之比等于系数之比,所以未指明是哪一种物质的反应速率,则无法计算;
D、t1至t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,根据方程式系数之比等于反应消耗的物质的量之比书写.
解答 解:A、可逆反应达到了平衡状态,但是反应仍然进行,故A错误;
B、根据表中的数据,t1至t2,消耗了A3mol/L、B1.5mol/L,生成了1.5mol/LC,故反应方程式为:2A+B?C,反应前A、B的浓度之比小于2:1,反应过程中消耗的A、B的浓度之比等于2:1,则转化率A的大于B,故B正确;
C、反应速率之比等于系数之比,所以未指明是哪一种物质的反应速率,则无法计算,故C错误;
D、根据表中的数据,t1至t2,消耗了A3mol/L、B1.5mol/L,生成了1.5mol/LC,故反应方程式为:2A+B?C,故D正确;
故选:BD.
点评 本题考查化学反应速率的计算及反应方程式的求算,注意得到了平衡状态,反应没有停止,难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
6.下列关于烷烃与烯烃的性质及反应类型叙述正确的是( )
| A. | 烷烃只含有饱和键,烯烃只含有不饱和键 | |
| B. | 烷烃不能发生加成反应,烯烃不能发生取代反应 | |
| C. | 烷烃不能发生氧化反应,烯烃可以发生氧化反应 | |
| D. | 烷烃与烯烃相比,发生加成反应的一定是烯烃 |
7.下列说法不能作为比较卤族元素非金属强弱依据的是( )
| A. | F2、Cl2、Br2、I2跟氢气反应的激烈程度逐渐减小 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减小 | |
| C. | F-、Cl-、Br-、I-的还原性依次增强 | |
| D. | HF、HCl、HBr、HI水溶液的酸性依次增强 |
11.下列化学用语书写正确的是( )
| A. | 氯离子的结构示意图: | |
| B. | CCl4的电子式: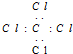 | |
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| D. | 用电子式表示氯化氢分子的形成过程:H+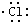 → → |
8.下列电子式表示正确的是( )
| A. | Cl2: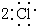 | B. | NaCl: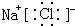 | C. | NaOH: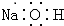 | D. | H2O: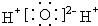 |
5.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 它们的原子核外电子层数随核电荷数的增多而增多 | |
| B. | 单质的颜色随核电荷数的增多而加深 | |
| C. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增多而增大 | |
| D. | 它们的氢化物的稳定性随核电荷数的增多而增强 |
6.613C可用于含碳化合物的结构分析,613C表示的是( )
| A. | 核外有13个电子,其中6个能参与成键 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数是13,原子序数是6,核内有7个质子 | |
| D. | 质量数是13,原子序数是6,核内有7个中子 |