题目内容
6.613C可用于含碳化合物的结构分析,613C表示的是( )| A. | 核外有13个电子,其中6个能参与成键 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数是13,原子序数是6,核内有7个质子 | |
| D. | 质量数是13,原子序数是6,核内有7个中子 |
分析 根据原子符号ZAX的含义以及原子序数=质子数=核电荷数=核外电子数,中子数=质量数-质子数来解答.
解答 解:A、613C的质子数为6,所以核外电子数为6,其中4个能参与成键,故A错误;
B、613C的质子数为6,所以核外电子数为6,故B错误;
C、613C的质子数为6,质量数为13,所以原子序数为6,核内有6个质子,故C错误;
D、613C的质子数为6,质量数为13,所以原子序数为6,中子数为13-6=7,故D正确;
故选D.
点评 本题主要考查了原子符号ZAX的含义以及原子序数=质子数=核电荷数=核外电子数,中子数=质量数-质子数,难度不大.

练习册系列答案
相关题目
16.在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率高 | |
| C. | t1至t2时刻该反应的速率为3mol•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
14.在一密闭容器中进行反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g),已知反应过程中某一时刻SO2、O2和SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达平衡时,可能存在的数据是( )
| A. | SO2为0.4 mol/L | B. | SO2为0.3 mol/L、SO3为0.3 mol/L | ||
| C. | SO2为0.25 mol/L | D. | O2为0.05 mol/L、SO3为0.1 mol/L |
1.有两种气态烃的混合物1L,完全燃烧可得同温同压下的3.8L二氧化碳和3.6L水蒸气,这两种烃可能是( )
| A. | C2H4、C4H6 | B. | C2H2、C4H6 | C. | C3H4、C4H8 | D. | C3H4、C3H6 |
11.下表是元素周期表的一部分,表中序号分别代表某一元素.请回答下列问题.
(1)①-⑩中,最活泼的金属元素是Na(写元素符号,下同);最不活泼的元素是Ar;可作半导体材料的元素是Si;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是N.
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);
碱性最强的是NaOH(填化学式),它与⑥的最高价氧化物的水化物反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);
碱性最强的是NaOH(填化学式),它与⑥的最高价氧化物的水化物反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
15.下列反应可能属于吸热反应的是( )
| A. | 燃烧反应 | B. | Mg与醋酸溶液的反应 | ||
| C. | 中和反应 | D. | Ba(OH)2•8H2O与NH4Cl |
16.下列有关化学反应速率的说法中正确的是( )
| A. | 用铁片与硫酸制取氢气时,硫酸浓度越大制取氢气的速率一定越快 | |
| B. | 等质量的锌粉和锌片与等物质的量浓度的盐酸反应,反应速率相等 | |
| C. | 升高温度对于放热反应可以加快反应速率,对于吸热反应可以减小反应速率 | |
| D. | 可逆反应中加入催化剂可以同时加快正逆反应速率 |
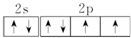 ,该元素的名称是氧;
,该元素的名称是氧;