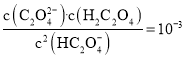题目内容
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
(1)写出 N2 的一种用途: ________________。
(2)B 物质的电子式为: ________________。
(3)HNO3与图中的物质 C 常用于检验 Cl-的存在,则 C 的化学式为______________。
(4)实验室制取物质 B 的化学方程式为 ______________。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为 ___________。
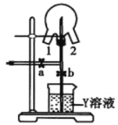
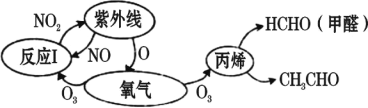
(6)如图装置可用于探究氯气与氨气的反应。实验时先通过三颈瓶瓶口 1 通入氨气,然后关闭 b 活塞,再通过瓶口 2 通入氯气。
①实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为________,请设计一个实验方案鉴定该固体中的阳离子____________
② 实验完毕后,观察到三颈瓶内还有黄绿色气体, 简述如何处理才能不污染环境___________________。
(7)将 3.2g 铜与 60.0mL 一定浓度的硝酸发生反应,铜完全溶解,产生 NO2 和 NO 混合气体的体积为 8.96L(标况)。待产生的气体全部释放后,向溶液加入 100mL 2.0mol/L 的 NaOH 溶液,恰好使溶液中的 Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 _______________mol/L。
【答案】作保护气或作制冷剂或用于合成氨等(合理即可) ![]() AgNO3 2NH4Cl + Ca(OH)2
AgNO3 2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O C + 4HNO3(浓)
CaCl2 + 2NH3↑ + 2H2O C + 4HNO3(浓) ![]() CO2↑ + 4NO2↑ + 2H2O 8NH3 + 3Cl2 = N2 + 6NH4Cl 取少量固体于试管中,加入NaOH溶液,微热,产生的气体在试管口用湿润的红色石蕊试纸检测,如果试纸变蓝,则证明该固体中含有NH4+ 将活塞b打开,Cl2即可被烧杯中的NaOH溶液吸收 10
CO2↑ + 4NO2↑ + 2H2O 8NH3 + 3Cl2 = N2 + 6NH4Cl 取少量固体于试管中,加入NaOH溶液,微热,产生的气体在试管口用湿润的红色石蕊试纸检测,如果试纸变蓝,则证明该固体中含有NH4+ 将活塞b打开,Cl2即可被烧杯中的NaOH溶液吸收 10
【解析】
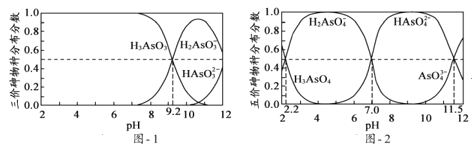
(1)~(5)由图可判断,气态氢化物B为NH3,+2价氧化物为NO,C为硝酸盐。可在此基础上结合氮的单质及其化合物的结构和性质解(1)~(5)小题;
(6)氯气有强氧化性,能将氨气氧化,还原产物HCl与NH3 反应生成NH4Cl固体;检验该固体中的阳离子即为检验NH4Cl中的NH4+;
②三颈瓶内黄绿色气体为Cl2,Cl2能和碱反应,故可用碱溶液吸收;
(7)原硝酸溶液中的HNO3的物质的量等于未被还原的HNO3和被还原的HNO3的物质的量总和。未被还原的HNO3的物质的量等于反应后溶液中的NO3-的物质的量;根据N元素守恒,被还原的HNO3的物质的量等于还原产物NO2和 NO的物质的量总和。利用题给数据分别计算即可求得原硝酸溶液的浓度。
(1) N2 性质稳定,可作保护气;液氮温度低,可作制冷剂;N2 还可用于合成氨,等等。
答案为:作保护气或作制冷剂或用于合成氨等(合理即可);
(2) B 为NH3,为共价化合物,电子式为:![]() 。
。
答案为:![]() ;
;
(3) 检验 Cl- 常用HNO3酸化的AgNO3 溶液,所以C 的化学式为AgNO3。
答案为:AgNO3;
(4) 实验室常用NH4Cl和碱石灰共热制取 NH3,化学方程式为:2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O。
CaCl2 + 2NH3↑ + 2H2O。
答案为:2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O;
CaCl2 + 2NH3↑ + 2H2O;
(5) 浓硝酸与木炭在加热条件下反应的化学方程式为:C + 4HNO3(浓) ![]() CO2↑ + 4NO2↑ + 2H2O。
CO2↑ + 4NO2↑ + 2H2O。
答案为:C + 4HNO3(浓) ![]() CO2↑ + 4NO2↑ + 2H2O;
CO2↑ + 4NO2↑ + 2H2O;
(6) ① 在三颈瓶内,氯气将氨气氧化成氮气,还原产物HCl与NH3 反应生成NH4Cl固体,所以发生反应的化学方程式为:8NH3 + 3Cl2 = N2 + 6NH4Cl;NH4Cl中NH4+ 的检验方法为:取少量固体于试管中,加入NaOH溶液,微热,产生的气体在试管口用湿润的红色石蕊试纸检测,如果试纸变蓝,则证明该固体中含有NH4+。
答案为:8NH3 + 3Cl2 = N2 + 6NH4Cl;取少量固体与试管中,加入NaOH溶液,微热,产生的气体在试管口用湿润的红色石蕊试纸检测,如果试纸变蓝,则证明该固体中含有NH4+;
② 三颈瓶内黄绿色气体为Cl2,Cl2能和碱反应,故可用碱溶液(如NaOH溶液)吸收,可将活塞b打开,Cl2即可被烧杯中的NaOH溶液吸收。
答案为:将活塞b打开,Cl2即可被烧杯中的NaOH溶液吸收;
(7) 根据分析可知,原硝酸溶液中的HNO3 的物质的量等于反应后溶液中的NO3- (未被还原的HNO3)和还原产物NO2 和 NO的物质的量总和(被还原的HNO3)。一、反应后溶液中的的NO3- :向反应后溶液加入NaOH 溶液恰好使溶液中的 Cu2+ 全部转化成沉淀后,溶液的溶质为NaNO3,则有:n(NO3-)=n(Na+)=100×10-3L×2.0mol/L=0.2mol;二、被还原的HNO3:还原产物为NO2 和 NO,所以,被还原的HNO3的物质的量为:![]() ;则原硝酸溶液的浓度为:
;则原硝酸溶液的浓度为:![]() 。
。
答案为:10。