题目内容
【题目】常温下,用![]() 的盐酸滴定
的盐酸滴定![]() 溶液
溶液![]() 。用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是
。用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是
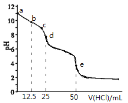
A.![]() 发生的主要离子反应:
发生的主要离子反应:![]()
B.在b点时,![]()
C.在d点时,![]()
D.在e点时![]()
【答案】D
【解析】
A.由图中曲线可知,d点溶液为NaHCO3溶液,e点溶液为NaCl溶液,故c→d发生的主要离子反应:CO32-+H+=HCO3-,故A错误;
B.b点时,有![]() 的Na2CO3转化成NaHCO3,由于CO32-的水解程度大于HCO3-的水解程度,故c(HCO3)->c(CO32-)>c(OH-),故B错误;
的Na2CO3转化成NaHCO3,由于CO32-的水解程度大于HCO3-的水解程度,故c(HCO3)->c(CO32-)>c(OH-),故B错误;
C.d点时,d点加入25mL盐酸时二者恰好反应生成碳酸氢钠,根据碳酸氢钠溶液中的质子守恒可得:c(OH-)=c(H+)+c(H2CO3)-c(CO32-),故C错误;
D.在e点时,根据电荷守恒可得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),由于c(Na+)=c(Cl-),则c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D正确;
故答案为D。

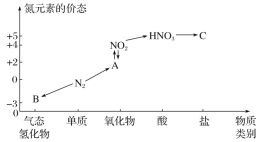
【题目】U、V、W、Y、Z是原子序数依次增大的短周期主族元素,U、Y在周期表中的相对位置如图;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
U | ||
Y |
(1)元素Z在周期表中位于第 ______ 族,我国首创以W组成的金属![]() 海水
海水![]() 空气电池作为能源的新型海水标志灯,它以海水为电解质溶液,靠空气中的氧气使W组成的金属不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。则该电源负极反应为 ______
空气电池作为能源的新型海水标志灯,它以海水为电解质溶液,靠空气中的氧气使W组成的金属不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。则该电源负极反应为 ______
(2)YO2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VO,有关反应的离子方程式为 ______ ,由此可知YO2和VO还原性较强的是(写化学式)______。
(3)V的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 ______
![]() 一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变如表中反应条件x,该平衡体系中随x递增y递增的是 ______(选填序号)。
一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变如表中反应条件x,该平衡体系中随x递增y递增的是 ______(选填序号)。
选项 | a | b | c | d |
x | 温度 | 温度 | 加入 | 加入甲的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
③向含4molV的最高价含氧酸的稀溶液中,逐渐加入Fe粉至过量。假设生成的气体只有一种,请在图中坐标系中画出n(Fe2+)随n(Fe)变化的示意图______

![]() 相同温度下,等体积、物质的量浓度都为
相同温度下,等体积、物质的量浓度都为![]() 的KZ和
的KZ和![]() 溶液的两种溶液中,离子总数相比较 ______
溶液的两种溶液中,离子总数相比较 ______
A.前者多![]() 一样多
一样多![]() 后者多
后者多![]() 无法判断.
无法判断.