题目内容
在一定条件下,反应N2+3H2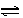 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
| A.v(H2)=0.03mol/(L·min) | B.v(N2)="0.005mol/(L·min)" |
| C.v(NH3)=0.17mol/(L·min) | D.v(NH3)=0.02mol/(L·min) |
B
解析试题分析:v(NH3)="Δc÷Δt=(1.7g÷17g/mol)÷2L÷5min=0.01mol/(L·min)." v(N2)="1/2" v(NH3)=" 0.005mol/(L·min)" ; v(H2)="3/2" v(NH3)=0.015mol/(L·min).因此正确选项为B。
考点:考查化学反应速率的概念机不同物质间的速率的关系的知识。

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是 ( )
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是 ( )
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO2、SO3均为0.15mol/L |
| C.SO2为0.25mol/L | D.SO3为0.4mol/L |
下列有关化学概念或原理的论述中,正确的是
| A.任何一个氧化还原反应都可以设计为电池,输出电能 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
在2 L的密闭容器中进行如下反应: CO(g)+H2O(g) CO2(g)+H2(g),有如下数据:
CO2(g)+H2(g),有如下数据:
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
A.正反应为吸热反应
B.实验1中,CO的转化率为80%
C.650℃时,化学平衡常数K=8/3
D.实验1再加入1.0 mol H2O,重新达到平衡时,n (CO2)为1.6 mol
下列叙述表示可逆反应N2 + 3H2 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( )
| A.N2、H2、NH3的百分含量相等 | B.3v(N2)正= v(H2)逆 |
| C.定容容器中,气体的密度不变 | D.N2、H2、NH3的浓度之比为1:3:2 |
在一定温度下,容积为2L的密闭容器中x(g).与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若其他条件不变,温度为T1和T2时,Y的体积分数与时间的关系如图(2)所示。下列说法正确的是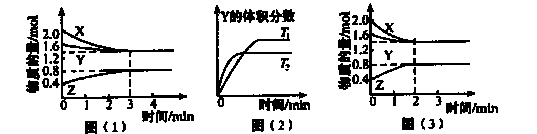
A.容器内发生的反应可以表示为2X(g)+Y(g) 2Z(g) 2Z(g) |
| B.保持其他条件不变,升高温度,该反应的平衡常数K减小 |
| C.反应前3 min内,v(Z)≈0.067 mol·L-1·min-1 |
| D.若改变反应条件,反应进程如图(3)所示,则改变的条件是增大压强 |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )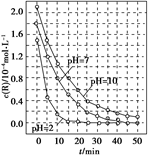
| A.在0-50 min之间, pH = 2和PH = 7时R的降解百分率不相等 |
| B.在 20-25 min之间, pH =" 10" 时R的平均降解速率为0.04 mol?L-1?min-1 |
| C.溶液酸性越强, R 的降解速率越小 |
| D.R的起始浓度和溶液的PH均影响R的降解速率 |
下列说法不正确的是
A.在固定体积的密闭容器中发生可逆反应A(s)+B(g)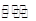 C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态 C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态 |
B.对于反应C(s)+CO2(g)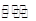 2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大 2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大 |
C.向0.1mol·L-1的NH3·H2O中加入氯化铵固体,则溶液中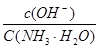 增大 增大 |
D.常温下向Mg(OH)2悬浊液中加入MgCl2浓溶液后,溶液中 不变 不变 |
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)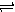 Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
| A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s) |
| B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2 |
| C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 |
| D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |