题目内容
在一定温度下,容积为2L的密闭容器中x(g).与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若其他条件不变,温度为T1和T2时,Y的体积分数与时间的关系如图(2)所示。下列说法正确的是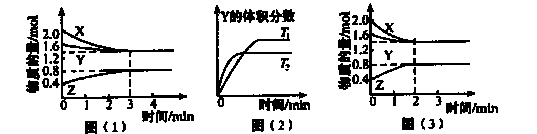
A.容器内发生的反应可以表示为2X(g)+Y(g) 2Z(g) 2Z(g) |
| B.保持其他条件不变,升高温度,该反应的平衡常数K减小 |
| C.反应前3 min内,v(Z)≈0.067 mol·L-1·min-1 |
| D.若改变反应条件,反应进程如图(3)所示,则改变的条件是增大压强 |
C
解析试题分析:A、由图(1)知,X、Y、Z的物质的量变化分别为0.6mol、0.2mol、0.4mol,容器内发生的反应可以表示为3X(g)+Y(g) 2Z(g),错误;B、由图(2)知,温度为T2时先达到平衡,T2>T1,T2时Y的体积分数较小,平衡正向移动,升高温度平衡向吸热反应方向移动,该反应吸热,保持其他条件不变,升高温度,该反应的平衡常数K增大,错误;C、反应前3 min内,v(Z)≈0.067 mol·L-1·min-1,正确;D、对比图(1)和(3)知,改变反应条件后平衡未移动,但缩短了达平衡的时间,则改变的条件是使用催化剂,错误。
2Z(g),错误;B、由图(2)知,温度为T2时先达到平衡,T2>T1,T2时Y的体积分数较小,平衡正向移动,升高温度平衡向吸热反应方向移动,该反应吸热,保持其他条件不变,升高温度,该反应的平衡常数K增大,错误;C、反应前3 min内,v(Z)≈0.067 mol·L-1·min-1,正确;D、对比图(1)和(3)知,改变反应条件后平衡未移动,但缩短了达平衡的时间,则改变的条件是使用催化剂,错误。
考点:考查化学平衡图像、化学平衡的移动、反应速率的计算及平衡常数的影响因素。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案下图是可逆反应X + Y  Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是 ( )
Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是 ( ) 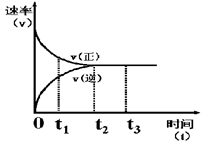
| A.t1时,正反应速率大于逆反应速率 |
| B.t2时,达到该条件下的最大反应限度 |
| C.t2- t3,反应不再发生,各物质的浓度相等 |
| D.t3后,该反应的反应限度有可能被外界条件改变 |
在一定条件下,反应N2+3H2 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
| A.v(H2)=0.03mol/(L·min) | B.v(N2)="0.005mol/(L·min)" |
| C.v(NH3)=0.17mol/(L·min) | D.v(NH3)=0.02mol/(L·min) |
下列措施对增大反应速率明显有效的是
| A.在K2SO4与BaCl2两溶液反应时,增大压强 |
| B.Fe与稀硫酸反应制取H2时,改用浓硫酸 |
| C.Na与水反应时增大水的用量 |
| D.Al在氧气中燃烧生成A12O3,将Al片改成Al粉 |
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应: 2X(g)+Y(g)  Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
| A.反应进行60s时,X、Y、Z的浓度相等 |
| B.反应进行80s时,逆反应速率大于正反应速率 |
| C.以X浓度变化表示的反应速率为0.06mol/(L?min) |
| D.反应进行80s时,Y物质的量浓度为0.03mol/L |
如图是可逆反应N2(g)+3H2(g) 2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )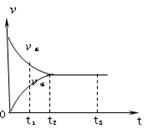
| A.t1时,只有正方向反应 | B.t2时,反应到达限度 |
| C.t2-t3,反应不再发生 | D.t2-t3,各物质的浓度相等且不再发生变化 |
高温下,某反应达平衡,化学平衡常数表达式为: ,恒容时,温度升高H2浓度减小。下列说法正确的是
,恒容时,温度升高H2浓度减小。下列说法正确的是
A.该反应化学方程式为:CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) |
| B.恒温恒容下,反应达平衡时,再通入一定量的CO2,CO的体积分数一定增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |
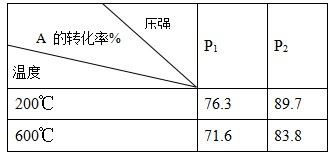
 2C(g)在不同温度和压强时A的转化率如表所示。由此可知,下列图像正确的是
2C(g)在不同温度和压强时A的转化率如表所示。由此可知,下列图像正确的是