题目内容
【题目】利用铁矿石(Fe2O3),可以制得Fe3[Fe(CN)6]2和Fe(SCN)3,请回答下列问题:
(1)基态Fe3+的价电子排布式为___________。
(2)O、S、C三种元素的电负性由大到小的顺序为___________,Fe(CO)5是一种浅黄色液体,熔点-20℃,沸点103℃。Fe(CO)5晶体类型是___________。
(3)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的分子为___________(任写一种),SCN-中碳原子的杂化类型为___________。第一电离能I1(N)___________I1(O)(填“大于”、“小于”或“等于”),理由是___________。
(4)钾晶体(其晶胞结构如图所示)的晶胞参数为apm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为___________pm,晶体钾的密度计算式是___________g/m3(设NA为阿伏加德罗常数的值)

【答案】3d5 O>S>C 分子晶体 CO2或N2O sp 大于 N原子p能级为半充满状态,更稳定 ![]()
![]()
【解析】
(1)Fe是26号元素,Fe原子失去3个电子变为Fe3+,根据构造原理,书写基态Fe3+的价电子排布式;
(2)由于非金属性越强,其电负性越大。分子晶体的熔沸点较低,离子晶体的熔沸点较高,原子晶体的熔沸点很高;
(3)等电子体中含有的原子数相同,原子的最外层电子数也相同,据此书写SCN-的等电子体的分子式,根据SCN-的原子结合方式判断其中碳原子的杂化类型。一般情况下同一周期元素的第一电离能随原子序数的增大而增大,当原子核外电子处于半满、全满或全空时电离能较大;
(4)小球处于晶胞对角线的位置,先用均摊法计算一个晶胞中含有的K原子数,然后根据晶胞参数为apm计算晶胞的密度。
(1)Fe是26号元素,Fe原子核外有26个电子,核外电子排布式是1s22s22p63s23p63d64s2,Fe原子失去3个电子变为Fe3+,根据构造原理,可得基态Fe3+的价电子排布式为3d5;
(2)由于非金属性越强,其电负性越大。元素的非金属性:O>S>C,所以可知三种元素的电负性由大到小的顺序是:O>S>C;Fe(CO)5是一种浅黄色液体,熔点-20℃,沸点103℃,熔沸点较低,说明Fe(CO)5是分子晶体;
(3)等电子体中含有的原子数相同,原子的最外层电子数也相同,则与SCN-互为等电子体的分子为CO2或N2O。SCN-的中心原子碳原子的杂化方式与CO2的中心原子的杂化方式相同,因此其中的C原子的杂化方式是sp杂化。一般情况下,同一周期元素的第一电离能随原子序数的增大而增大,当原子核外电子处于半满、全满或全空时电离能较大。由于N原子p能级为半充满状态,更稳定,所以其第一电离能比O元素的大;
(5)晶胞参数是apm,则晶胞的体对角线为![]() apm,由晶胞结构可知4r=
apm,由晶胞结构可知4r=![]() apm,则K原子半径r=
apm,则K原子半径r=![]() pm;由于晶胞参数是apm,所以晶胞的体积V=(apm)3=(a×10-10)3m3;在一个晶胞中含有的K原子数目为:
pm;由于晶胞参数是apm,所以晶胞的体积V=(apm)3=(a×10-10)3m3;在一个晶胞中含有的K原子数目为:![]() =2,则该晶体的密度ρ=
=2,则该晶体的密度ρ=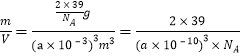 g/m3。
g/m3。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案【题目】某小组研究FeCl3与Na2S的反应,设计了如下实验:
| 实验a | 实验b | 实验c | |
FeCl3 体积 | 5 mL | 10 mL | 30 mL | |
实验 现象 | 产生黑色浑浊,混合液pH=11.7 | 黑色浑浊度增大,混合液pH=6.8 | 黑色浑浊比实验b明显减少,观察到大量黄色浑浊物,混合液pH=3.7 |
I. 探究黑色沉淀的成分
查阅资料:Fe2S3(黑色)在空气中能够稳定存在,FeS(黑色)在空气中易变质为Fe(OH)3
设计实验:分别取实验a、b、c中沉淀放置于空气中12小时,a中沉淀无明显变化。
b、c中黑色沉淀部分变为红褐色。
(1)① 同学甲认为实验a中黑色沉淀为Fe2S3,实验b、c的黑色沉淀物中既有Fe2S3又有FeS,依据的实验现象是________。
② 同学乙认为实验b的黑色沉淀物中有FeS则一定混有S,理由是_________。
③ 设计实验检验b的黑色沉淀物中混有硫。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
已知:硫在酒精溶液中的溶解度随乙醇质量分数的增大而增大。
实验证明了b中黑色沉淀混有S,试剂a是_____,观察到的现象为_____。
II. 探究实验a中Fe3+与S2-没有发生氧化还原反应的原因
经查阅资料,可能的原因有两种:
原因1:pH影响了Fe3+与S2-的性质,二者不能发生氧化还原反应。
原因2:沉淀反应先于氧化还原反应发生,导致反应物浓度下降,二者不能发生氧化还原反应。
设计实验:电极材料为石墨

(2)①试剂X和Y分别是__________
②甲认为若右侧溶液变浑浊,说明Fe3+与S2-发生了氧化还原反应。是否合理?说明理由_______。
③乙进一步实验证明该装置中Fe3+与S2-没有发生氧化还原反应,实验操作及现象是_______。
④由此得出的实验结论是__________。
III. 探究实验c随着FeCl3溶液的增加,黑色沉淀溶解的原因
实验1 | 实验2 |
|
|
(3)①用离子方程式解释实验1中的现象_________、_________(写离子方程式)。
②结合化学平衡等反应原理及规律解释实验2中现象相同与不同的原因______。