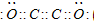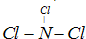题目内容
现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体。回答下列问题:
(1)A分别与B、C形成的最简单化合物中,稳定性 > (用分子式表示),其中A与B形成的最简单化合物分子的空间构型为 ;
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为 。
(3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1∶1,则丙中含有的化学键类型是 ;
(4)B元素的最高价氧化物对应的水化物与其氢化物反应生成的盐的水溶液呈 性(填“酸”、“碱”或“中”),用离子方程式解释原因 ;
(5)写出实验室制取单质E的离子方程式是 。
(1)H2O>NH3(2分) 三角锥形(2分)
(2)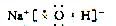 (2分)
(2分)
(3)离子键和共价键(或非极性共价键)(2分)
(4)酸(1分)
(5)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (3分)
解析

练习册系列答案
相关题目
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.