题目内容
【题目】按要求对下图中两极进行必要的联接并填空:

(1)在A图中,使铜片上冒H2气泡。请加以必要联接__________(在答题卡的图中画线),则联接后的装置叫_________。电极反应式:锌板:____________________;铜板:___________。
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出____________。加以必要的联接后,该装置叫___________。电极反应式:a极:___________________________b极:____________________________。经过一段时间后,停止反应并搅均溶液,溶液的pH值________________(升高、降低、不变),加入一定量的____________后,溶液能恢复至与电解前完全一致。
(3)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+![]() O2(g) ==== CH3OH(g) △H=-128.5kJ/mol
O2(g) ==== CH3OH(g) △H=-128.5kJ/mol
副反应有:CH4(g)+![]() O2(g) ==== CO(g)+2H2O(g) △H=a kJ/mol
O2(g) ==== CO(g)+2H2O(g) △H=a kJ/mol
CH4(g)+2O2(g) ==== CO2(g)+2H2O(g) △H=b kJ/mol
CH4(g)+O2(g) ==== HCHO(g) +H2O(g) △H=c kJ/mol
甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为_____________________。
【答案】  原电池 Zn-2e- =Zn2+ 2H+ +2e-=H2↑ O2 电解池 Cu2++2e- =Cu 4OH――4e-=O2↑+2H2O 降低 CuO或者CuCO3 CH3OH(g)+1/2O2(g)→HCHO(g)+H2O(g) △H =(c +128.5)kJ·mol-1
原电池 Zn-2e- =Zn2+ 2H+ +2e-=H2↑ O2 电解池 Cu2++2e- =Cu 4OH――4e-=O2↑+2H2O 降低 CuO或者CuCO3 CH3OH(g)+1/2O2(g)→HCHO(g)+H2O(g) △H =(c +128.5)kJ·mol-1
【解析】(1)A图中,Cu与硫酸不反应,无氢气产生,现在要使铜上产生H2气体,必须形成原电池,让铜作正极,溶液中的H+在铜上得到电子,生成H2。连接的装置如右图:  ;此装置叫做原电池;锌做负极失去电子,电极方程式为:Zn-2e- =Zn2+;铜作正极,溶液中的氢离子得到电子生成H2,电极方程式为:2H++2e-=H2↑。
;此装置叫做原电池;锌做负极失去电子,电极方程式为:Zn-2e- =Zn2+;铜作正极,溶液中的氢离子得到电子生成H2,电极方程式为:2H++2e-=H2↑。
(2)B图中,a、b均为惰性电极,不参与反应,则此装置必为电解池,a极析出铜,则a极为阴极,电极方程式为:Cu2++2e- =Cu ;b极为阳极,溶液中的OH-失去电子生成O2,发生的电极反应式为:4OH――4e-=O2↑+2H2O。由于OH-失去电子生成O2,OH-浓度减小,导致H+浓度增大,溶液的酸性增强,pH值降低。由上分析可知:阳极析出O2,阴极析出Cu,溶液中生成HNO3 ,若要使溶液恢复至与电解前完全一致,则可以加入CuO或CuCO3 与生成的HNO3 反应,使生成的HNO3消耗掉,同时生成电解时消耗的Cu2+和H2O 。故答案依次为: O2 、电解池、Cu2++2e- =Cu、 4OH――4e-=O2↑+2H2O、 降低、 CuO或者CuCO3
(3)根据盖斯定律,几个热化学方程式相加减可得到要求的新的热化学方程式。先写出要求的化学方程式,再将新的化学方程式与已知的化学方程式对比做出判断。要求的化学方程式为:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g),与上面的方程式对比发现,只要将已知的第四个热化学方程式减去第一个热化学方程式即可得到要求的化学方程式,同时反应热也相减,故要求的热化学方程式的反应热为c kJ/mol-(-128.5kJ/mol)=(c +128.5)kJ·mol-1。答案为:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) △H =(c +128.5)kJ·mol-1

【题目】某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42﹣、CO32﹣ .
(1)为了进一步确认,对该溶液进行实验检测: 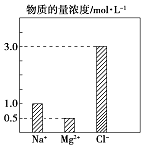
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 仔细观察坐标图 | 肯定无 | 肯定无该离子的理由 |
步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 | 肯定无该离子的理由 |
步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42﹣、H+;肯定无Ba2+ | 肯定有H+的理由 |
(2)实验操作的步骤三中称量沉淀前的实验操作步骤有:过滤、、灼烧、在干燥器中冷却.
(3)原溶液中H+物质的量浓度为mol/L.
(4)向溶液中加入NaHCO3溶液,反应的离子方程式为: .
(5)若向 100mL 该溶液中加入 1mol/L 的 Ba(OH)2溶液,恰好沉淀完全时加入的Ba(OH)2溶液体积为L.