题目内容
【题目】某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42﹣、CO32﹣ .
(1)为了进一步确认,对该溶液进行实验检测: 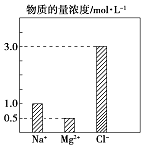
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 仔细观察坐标图 | 肯定无 | 肯定无该离子的理由 |
步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 | 肯定无该离子的理由 |
步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42﹣、H+;肯定无Ba2+ | 肯定有H+的理由 |
(2)实验操作的步骤三中称量沉淀前的实验操作步骤有:过滤、、灼烧、在干燥器中冷却.
(3)原溶液中H+物质的量浓度为mol/L.
(4)向溶液中加入NaHCO3溶液,反应的离子方程式为: .
(5)若向 100mL 该溶液中加入 1mol/L 的 Ba(OH)2溶液,恰好沉淀完全时加入的Ba(OH)2溶液体积为L.
【答案】
(1)CO32﹣;碳酸根离子和镁离子之间会反应;Fe3+;该离子为黄色;电荷守恒
(2)洗涤
(3)1.2
(4)H++HCO3﹣=H2O+CO2↑
(5)0.1
【解析】解:溶液中含有镁离子,所以一定不含CO32﹣ , 根据电荷守恒,阳离子正电荷浓度总和:1mol/L+0.5×2mol/L=2mol/L,该溶液呈无色、透明、均一状态,一定不含Fe3+ , 加入足量BaCl2溶液,生成23.3g即0.1mol白色沉淀硫酸钡,再加稀硝酸,沉淀不消失,一定含有硫酸根0.1mol,一定不含钡离子,阴离子负电荷总浓度3mol/L+0.1mol/L×2=3.2mol/L,所以一定含有氢离子,浓度是1.2mol/L,所以答案是:CO32﹣;碳酸根离子和镁离子之间会反应;Fe3+;该离子为黄色;电荷守恒;(2)实验操作的步骤三中称量沉淀前的实验操作步骤有:过滤、洗涤、灼烧、在干燥器中冷却,所以答案是:洗涤;(3)原溶液中H+物质的量浓度为1.2mol/L,所以答案是:1.2;(4)溶液中含有氢离子,向溶液中加入NaHCO3溶液,反应的离子方程式为:H++HCO3﹣=H2O+CO2↑,所以答案是:H++HCO3﹣=H2O+CO2↑;(5)向100mL 该溶液中含有硫酸根0.1mol,向100mL该溶液中加入1mol/L 的 Ba(OH)2溶液,恰好沉淀完全时,加入的Ba(OH)2溶液物质的量是0.1mol,体积是 ![]() =0.1L,所以答案是:0.1.
=0.1L,所以答案是:0.1.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
