题目内容
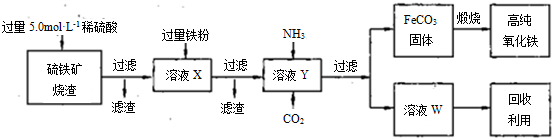
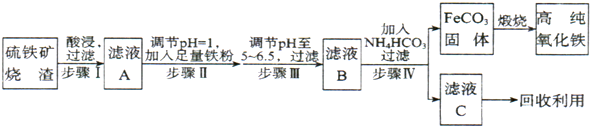
髙纯氧化铁(a-Fe2O3)是现代电子工业重要材料.实验室用硫铁矿烧渣 (Fe2O3、FeO、SiO2等)为原料制备髙纯氧化铁的步骤如图所示.请回答有关问题:
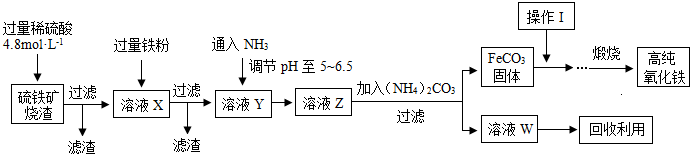
(1)过滤操作中的玻璃仪器为 .
(2)实验室需240mL4.8mol?L-1的硫酸溶液,若用18.4mol?L-1的浓硫酸进行配制,所需要的最主要仪器为 .
(3 )溶液X发生反应的离子方程式为 .
(4)简述如何检验溶液Z中的阴离子 .
(5)操作I的名称是 .列举W的一种用途 .
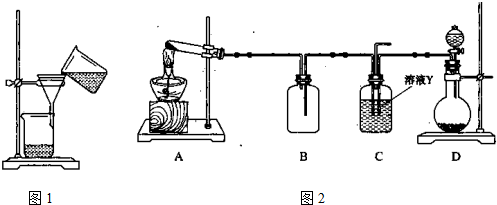
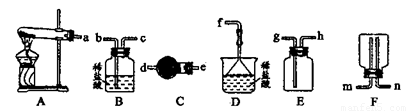
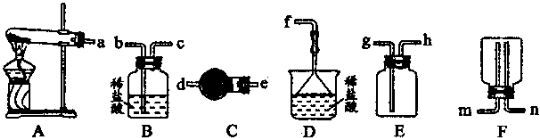
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理.选择合适的仪器,按照气体流向排序(如图所示大写字母表示) .
(7)将多余的氨气通入水中,若得到25℃0.2mol?L-1的NH3?H2O溶液,现提供0.1 mol?L-1盐酸溶液,请你设计实验,证明NH3?H2O的电离程度大于NH4Cl的水解程度.简述实验方案及结论 .

(1)过滤操作中的玻璃仪器为
(2)实验室需240mL4.8mol?L-1的硫酸溶液,若用18.4mol?L-1的浓硫酸进行配制,所需要的最主要仪器为
(3 )溶液X发生反应的离子方程式为
(4)简述如何检验溶液Z中的阴离子
(5)操作I的名称是
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理.选择合适的仪器,按照气体流向排序(如图所示大写字母表示)

(7)将多余的氨气通入水中,若得到25℃0.2mol?L-1的NH3?H2O溶液,现提供0.1 mol?L-1盐酸溶液,请你设计实验,证明NH3?H2O的电离程度大于NH4Cl的水解程度.简述实验方案及结论
分析:(1)根据过滤中的“一贴、二低、三靠”,过滤操作中用的三种玻璃仪器,分别是烧杯、漏斗、玻璃棒;
(2)根据配制一定物质的量浓度溶液用到仪器所需要的最主要仪器为250mL容量瓶;
(3)硫铁矿烧渣加过量的硫酸溶液,酸会和Fe2O3、FeO反应,生成Fe2+、Fe3+,而与SiO2不反应,加过量铁粉,铁粉和H+、Fe3+反应,据此解答;
(4)过量铁粉和H+、Fe3+反应后过滤,溶液中主要离子成分为Fe2+、通入氨气,调节PH至5-6.5,生成氢氧化铁沉淀,此时溶液中主要离子成分为SO42-、NH4+,所以需检验溶液Z中的阴离子SO42-;
(5)固体从溶液中出来需洗去表面可溶性的杂质离子;W为硫酸铵,可作化肥;
(6)根据氨气制备实验流程为:发生装置→净化→收集→尾气处理选择仪器,A为发生装置,C为净化装置,E为为收集装置,氨气是有毒气体,D为尾气处理装置;
(7)比较氨水的电离和氯化铵的水解能力大小,通过等浓度等体积的两者混合液的PH,将两份溶液等体积溶液混合测得溶液的pH大于7,说明铵根离子的水解能力小于氨水的电离能力;
(2)根据配制一定物质的量浓度溶液用到仪器所需要的最主要仪器为250mL容量瓶;
(3)硫铁矿烧渣加过量的硫酸溶液,酸会和Fe2O3、FeO反应,生成Fe2+、Fe3+,而与SiO2不反应,加过量铁粉,铁粉和H+、Fe3+反应,据此解答;
(4)过量铁粉和H+、Fe3+反应后过滤,溶液中主要离子成分为Fe2+、通入氨气,调节PH至5-6.5,生成氢氧化铁沉淀,此时溶液中主要离子成分为SO42-、NH4+,所以需检验溶液Z中的阴离子SO42-;
(5)固体从溶液中出来需洗去表面可溶性的杂质离子;W为硫酸铵,可作化肥;
(6)根据氨气制备实验流程为:发生装置→净化→收集→尾气处理选择仪器,A为发生装置,C为净化装置,E为为收集装置,氨气是有毒气体,D为尾气处理装置;
(7)比较氨水的电离和氯化铵的水解能力大小,通过等浓度等体积的两者混合液的PH,将两份溶液等体积溶液混合测得溶液的pH大于7,说明铵根离子的水解能力小于氨水的电离能力;
解答:解:(1)过滤时要注意一贴、二低、三靠.一贴是指滤纸紧贴漏斗内壁.二低是指滤纸低于漏斗边缘,液面低于滤纸边缘.三靠是指上面的烧杯紧靠玻璃棒,所以实验过程中用到的三种玻璃仪器是漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
(2)配制一定物质的量浓度溶液必须用到容量瓶,容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,所以240mL4.8mol?L-1的硫酸溶液所需要的最主要仪器为250mL容量瓶,
故答案为:250mL容量瓶;
(3)硫铁矿烧渣 (Fe2O3、FeO、SiO2等)加入硫酸,酸会和Fe2O3、FeO反应,生成Fe2+、Fe3+,而与SiO2不反应,过滤得到溶液X的主要离子成分为SO42-、H+、Fe2+、Fe3+,加过量铁粉,铁粉和H+、Fe3+反应,2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑,
故答案为:2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑;
(4)过量铁粉和H+、Fe3+反应后过滤,溶液中主要离子成分为Fe2+、通入氨气,调节PH至5-6.5,生成氢氧化铁沉淀,此时溶液中主要离子成分为SO42-、NH4+,所以需检验溶液Z中的阴离子SO42-,检验SO42-的操作为取少量溶液Z于试管中,然后加盐酸,无沉淀产生,再加氯化钡溶液,有白色沉淀产生,证明有SO42-,
故答案为:检验SO42-的操作为:取少量溶液Z于试管中,然后加盐酸,无沉淀产生,再加氯化钡溶液,有白色沉淀产生,证明有SO42-;
(5)固体从溶液中出来表面吸附有溶液中的可溶性的杂质离子,需通过洗涤洗去;溶液Z加碳酸铵生成硫酸亚铁和硫酸氨,所以W为硫酸铵,可作化肥,
故答案为:洗涤;化肥;
(6)实验室用氯化铵和氢氧化钙固体加热生成氨气和水来制取氨气,故选A装置,生成的氨气中含有水蒸气,所以用球形干燥管进行干燥选C,氨气极易溶于水密度小于空气的平均密度,所以选E用排空气法收集从h口进,氨气具有刺激性,氨气是有毒气体,需进行尾气吸收选D,
故答案为:ACED;
(7)铵根离子水解溶液呈酸性,氨水电离呈碱性,25℃0.2mol.L-1的NH3?H2O溶液和0.1mol.L-1盐酸溶液等体积混合,生成等物质的量浓度的氨水和氯化铵,测溶液的PH值大于7,说明铵根离子的水解能力小于氨水的电离能力,
故答案为:将25℃0.2mol.L-1的NH3?H2O溶液和0.1mol.L-1盐酸溶液等体积混合,测溶液的PH值,PH大于7,证明NH3?H2O的电离程度大于NH4Cl的水解程度;
故答案为:漏斗、烧杯、玻璃棒;
(2)配制一定物质的量浓度溶液必须用到容量瓶,容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,所以240mL4.8mol?L-1的硫酸溶液所需要的最主要仪器为250mL容量瓶,
故答案为:250mL容量瓶;
(3)硫铁矿烧渣 (Fe2O3、FeO、SiO2等)加入硫酸,酸会和Fe2O3、FeO反应,生成Fe2+、Fe3+,而与SiO2不反应,过滤得到溶液X的主要离子成分为SO42-、H+、Fe2+、Fe3+,加过量铁粉,铁粉和H+、Fe3+反应,2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑,
故答案为:2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑;
(4)过量铁粉和H+、Fe3+反应后过滤,溶液中主要离子成分为Fe2+、通入氨气,调节PH至5-6.5,生成氢氧化铁沉淀,此时溶液中主要离子成分为SO42-、NH4+,所以需检验溶液Z中的阴离子SO42-,检验SO42-的操作为取少量溶液Z于试管中,然后加盐酸,无沉淀产生,再加氯化钡溶液,有白色沉淀产生,证明有SO42-,
故答案为:检验SO42-的操作为:取少量溶液Z于试管中,然后加盐酸,无沉淀产生,再加氯化钡溶液,有白色沉淀产生,证明有SO42-;
(5)固体从溶液中出来表面吸附有溶液中的可溶性的杂质离子,需通过洗涤洗去;溶液Z加碳酸铵生成硫酸亚铁和硫酸氨,所以W为硫酸铵,可作化肥,
故答案为:洗涤;化肥;
(6)实验室用氯化铵和氢氧化钙固体加热生成氨气和水来制取氨气,故选A装置,生成的氨气中含有水蒸气,所以用球形干燥管进行干燥选C,氨气极易溶于水密度小于空气的平均密度,所以选E用排空气法收集从h口进,氨气具有刺激性,氨气是有毒气体,需进行尾气吸收选D,
故答案为:ACED;
(7)铵根离子水解溶液呈酸性,氨水电离呈碱性,25℃0.2mol.L-1的NH3?H2O溶液和0.1mol.L-1盐酸溶液等体积混合,生成等物质的量浓度的氨水和氯化铵,测溶液的PH值大于7,说明铵根离子的水解能力小于氨水的电离能力,
故答案为:将25℃0.2mol.L-1的NH3?H2O溶液和0.1mol.L-1盐酸溶液等体积混合,测溶液的PH值,PH大于7,证明NH3?H2O的电离程度大于NH4Cl的水解程度;
点评:本题主要考查了物质的量浓度的配制、过滤、硫酸根离子的检验等知识,较为综合,掌握实验方案的设计原理是解答的关键,题目难度中等.

练习册系列答案
相关题目