题目内容
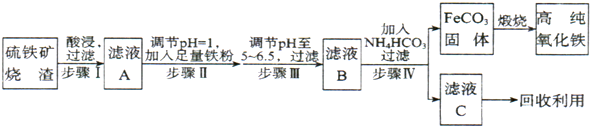
现代循环经济要求综合考虑环境污染和经济效益.高纯氧化铁可作现代电子工业的材料,以下是以硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁α-Fe2O3)的生产流程示意图:

(1)步骤Ⅰ中过滤所得滤渣的主要成分是
(2)步骤Ⅱ中加入铁粉的目的是
(3)步骤Ⅲ中可选用
A.稀硝酸
B.双氧水
C.氨水
D.高锰酸钾溶液
(4)写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式:
(5)从滤液C中回收的主要物质的一种用途是

(1)步骤Ⅰ中过滤所得滤渣的主要成分是
SiO2
SiO2
.(2)步骤Ⅱ中加入铁粉的目的是
将Fe3+还原为Fe2+
将Fe3+还原为Fe2+
.(3)步骤Ⅲ中可选用
C
C
调节溶液的pH.A.稀硝酸
B.双氧水
C.氨水
D.高锰酸钾溶液
(4)写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式:
4FeCO3+O2
2Fe2O3+4CO2
| ||
4FeCO3+O2
2Fe2O3+4CO2
.
| ||
(5)从滤液C中回收的主要物质的一种用途是
氮肥
氮肥
.分析:在矿铁中加入酸,SiO2不与酸反应,过滤后所得滤渣为SiO2,滤液A中加入过量铁粉将Fe3+还原为Fe2+,可加入氨水调节溶液pH至5~6.5,过滤后在滤液中加入碳酸氢铵可生成FeCO3,应高温煅烧可得Fe2O3,滤液C为铵盐,可作为氮肥施用.
解答:解:(1)SiO2不与酸反应,过滤后所得滤渣为SiO2,故答案为:SiO2;
(2)滤液A中加入过量铁粉将Fe3+还原为Fe2+,故答案为:将Fe3+还原为Fe2+;
(3)步骤Ⅲ可加入氨水调节溶液pH至5~6.5,其它物质都具有氧化性,可将亚铁离子氧化,故答案为:C;
(4)FeCO3高温煅烧可得Fe2O3,反应的方程式为4FeCO3+O2
2Fe2O3+4CO2,故答案为:4FeCO3+O2
2Fe2O3+4CO2;
(5)滤液C为铵盐,可作为氮肥施用故答案为:氮肥.
(2)滤液A中加入过量铁粉将Fe3+还原为Fe2+,故答案为:将Fe3+还原为Fe2+;
(3)步骤Ⅲ可加入氨水调节溶液pH至5~6.5,其它物质都具有氧化性,可将亚铁离子氧化,故答案为:C;
(4)FeCO3高温煅烧可得Fe2O3,反应的方程式为4FeCO3+O2
| ||
| ||
(5)滤液C为铵盐,可作为氮肥施用故答案为:氮肥.
点评:本题考查物质的制备和分离操作,侧重于学生分析能力、实验能力和综合运用化学知识能力的考查,为高考常见题型,题目难度不大,注意根据实验流程以及相关物质的性质解答该题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目