题目内容
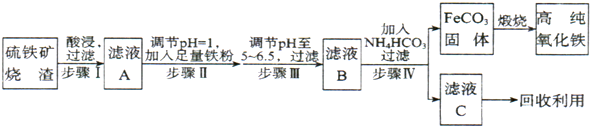
高纯氧化铁(α-Fe2O3)是现代电子工业的重要材料.实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下: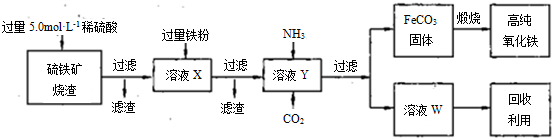
回答下列问题:
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应.写出该反应的离子方程式:
(2)实验室欲用18.4mol?L-1的浓硫酸配制100mL 5.0mol?L-1的硫酸溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(3)某同学用如图1所示装置进行过滤操作.
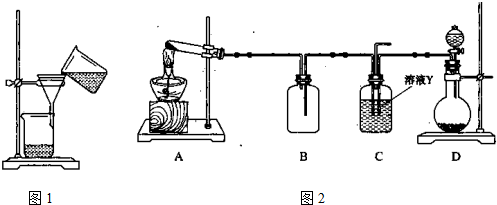
①请指出其中的错误之处:
②过滤后,洗涤过滤器中少量沉淀的方法是
(4)某同学用图2所示实验装置(尾气吸收装置未画出)向溶液Y中通入NH3和CO2.
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为
②下列各项制备实验中,也可利用装置D处仪器完成的是
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素.用pH试纸测定该溶液pH的方法是
分析:(1)向硫铁矿烧渣中加入硫酸,SiO2不与酸反应,氧化铁和氧化亚铁分别与硫酸发生复分解反应得到硫酸铁和硫酸亚铁,过滤后所得滤渣为SiO2,滤液A中加入过量铁粉将Fe3+还原为Fe2+,此反应既为化合反应又为氧化还原反应,过滤后在滤液中通入氨气和二氧化碳发生复分解反应生成FeCO3和硫酸铵,高温煅烧FeCO3发生氧化还原反应得Fe2O3;
(2)配制一定物质的量浓度的溶液要用到一定体积的容量瓶;
(3)①根据过滤中的“一贴、二低、三靠”判断;②在过滤器中用蒸馏水洗涤沉淀;
(4)①从装置图可知,A用来制取氨气,D用来制取二氧化碳,根据此装置目的选择试剂;
②D装置为固体和液体反应不加热制气装置,符合此条件的可用D装置;
③A为制取氨气的装置,根据所用药品可写出方程式;
④根据pH试纸使用步骤回答;根据电荷守恒解答.
(2)配制一定物质的量浓度的溶液要用到一定体积的容量瓶;
(3)①根据过滤中的“一贴、二低、三靠”判断;②在过滤器中用蒸馏水洗涤沉淀;
(4)①从装置图可知,A用来制取氨气,D用来制取二氧化碳,根据此装置目的选择试剂;
②D装置为固体和液体反应不加热制气装置,符合此条件的可用D装置;
③A为制取氨气的装置,根据所用药品可写出方程式;
④根据pH试纸使用步骤回答;根据电荷守恒解答.
解答:解:(1)向硫铁矿烧渣中加入硫酸,SiO2不与酸反应,氧化铁和氧化亚铁分别与硫酸发生复分解反应得到硫酸铁和硫酸亚铁,过滤后所得滤渣为SiO2,滤液A中加入过量铁粉将Fe3+还原为Fe2+,此反应既为化合反应又为氧化还原反应,过滤后在滤液中通入氨气和二氧化碳发生复分解反应生成FeCO3和硫酸铵,高温煅烧FeCO3发生氧化还原反应得Fe2O3,由以上分析可知,符合条件的离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(2)配制一定物质的量浓度的溶液要用到一定体积的容量瓶,此实验需要配制100 mL 5.0mol?L-1的硫酸溶液,故需要100mL容量瓶,故答案为:100mL容量瓶;
(3)①过滤要符合“一贴、二低、三靠”,此图示缺少两靠,即烧杯紧靠玻璃棒、玻璃棒紧靠三层滤纸处,或答成未用玻璃棒引流也可以,
故答案为:未用玻璃棒引流或烧杯未紧靠玻璃棒,玻璃棒没紧靠三层滤纸;
②在过滤器中用蒸馏水洗涤沉淀,具体操作为:沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次,
故答案为:沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次;
(4))①从装置图可知,A用来制取氨气,所用试剂为氯化铵和氢氧化钙,D用来制取二氧化碳,所用试剂为大理石和稀盐酸,
故答案为:ac;bf;
②D装置为固体和液体反应不加热制气装置,用所给试剂制取氯气、二氧化硫、氧气、乙酸乙酯都需要加热,故不符合,制取氢气不需要加热符合;
故答案为:E;
③A为制取氨气的装置,实验室用氯化铵和氢氧化钙共热制取氨气,反应方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+H2O;
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+H2O;
④溶液的酸碱度具体测定方法是:用洁净、干燥的玻璃棒蘸取待测溶液,点在在放在干燥的玻璃皿或白瓷板上的干燥pH试纸中央,待变色后立即与标准比色卡对比读数测得pH;根据电荷守恒,c[NH4+]+c[H+]=c[OH-]+2c[SO42-],因溶液呈中性,则有c[H+]=c[OH-],所以c[NH4+]=2c[SO42-],
故答案为:用洁净、干燥的玻璃棒蘸取待测溶液,点在在放在干燥的玻璃皿或白瓷板上的干燥pH试纸中央,待变色后立即与标准比色卡对比读数;c[NH4+]=2c[SO42-].
故答案为:Fe+2Fe3+=3Fe2+;
(2)配制一定物质的量浓度的溶液要用到一定体积的容量瓶,此实验需要配制100 mL 5.0mol?L-1的硫酸溶液,故需要100mL容量瓶,故答案为:100mL容量瓶;
(3)①过滤要符合“一贴、二低、三靠”,此图示缺少两靠,即烧杯紧靠玻璃棒、玻璃棒紧靠三层滤纸处,或答成未用玻璃棒引流也可以,
故答案为:未用玻璃棒引流或烧杯未紧靠玻璃棒,玻璃棒没紧靠三层滤纸;
②在过滤器中用蒸馏水洗涤沉淀,具体操作为:沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次,
故答案为:沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次;
(4))①从装置图可知,A用来制取氨气,所用试剂为氯化铵和氢氧化钙,D用来制取二氧化碳,所用试剂为大理石和稀盐酸,
故答案为:ac;bf;
②D装置为固体和液体反应不加热制气装置,用所给试剂制取氯气、二氧化硫、氧气、乙酸乙酯都需要加热,故不符合,制取氢气不需要加热符合;
故答案为:E;
③A为制取氨气的装置,实验室用氯化铵和氢氧化钙共热制取氨气,反应方程式为:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
④溶液的酸碱度具体测定方法是:用洁净、干燥的玻璃棒蘸取待测溶液,点在在放在干燥的玻璃皿或白瓷板上的干燥pH试纸中央,待变色后立即与标准比色卡对比读数测得pH;根据电荷守恒,c[NH4+]+c[H+]=c[OH-]+2c[SO42-],因溶液呈中性,则有c[H+]=c[OH-],所以c[NH4+]=2c[SO42-],
故答案为:用洁净、干燥的玻璃棒蘸取待测溶液,点在在放在干燥的玻璃皿或白瓷板上的干燥pH试纸中央,待变色后立即与标准比色卡对比读数;c[NH4+]=2c[SO42-].
点评:本题综合考查了氧化铁的制备、氨气、二氧化碳的制备、过滤、配制一定浓度的溶液作、pH的测量基本操及离子浓度大小比较等内容,较基础.

练习册系列答案
相关题目