题目内容
6.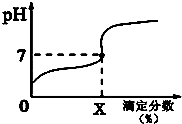 常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )| A. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{c({A}^{-})}$的值减小 | |
| B. | HA的电离常数KHA=$\frac{1{0}^{-7}X}{100-X}$(x为滴定分数) | |
| C. | 当滴定分数为100时,溶液中水的电离程度最大 | |
| D. | 滴定分数大于100时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)>c(H+) |
分析 A、HA为弱酸存在电离平衡,加水稀释促进电离,HA物质的量减小,A-物质的量增大;
B、X点对应溶液PH=7,溶液呈中性,c(H+)=10-7mol/L,溶液中电荷守恒得到c(Na+)=c(A-),结合滴定分数和电离平衡常数概念计算;
C、当滴定分数为100时,溶液中前后生成强碱弱酸盐,水解显碱性促进水的电离;
D、滴定分数大于100时,氢氧化钠过量可能c(A-)<c(OH-);
解答 解:A、HA为弱酸存在电离平衡,加水稀释促进电离,HA物质的量减小,A-物质的量增大,同一溶液中体积相同,溶液中$\frac{c(HA)}{c({A}^{-})}$的值减小,故A正确;
B、X点对应溶液PH=7,溶液呈中性,c(H+)=10-7mol/L,溶液中电荷守恒得到c(Na+)=c(A-),滴定分数是每毫升标准滴定溶液相当于被滴定物质的质量,结合滴定分数和电离平衡常数概念计算得到,HA的电离常数KHA=$\frac{1{0}^{-7}X}{100-X}$,故B正确;
C、当滴定分数为100时,溶液中前后生成强碱弱酸盐,水解显碱性促进水的电离,酸碱溶液抑制水的电离,所以恰好反应时溶液中水的电离程度最大,故C正确;
D、滴定分数大于100时,氢氧化钠过量,溶液中离子浓度大小可能为:c(A-)<c(OH-),溶液中离子浓度关系不一定是c(Na+)>c(A-)>c(OH-)>c(H+),故D错误;
故选D.
点评 本题考查了弱电解质电离平衡的分析计算,滴定分数和图象理解应用,注意水的电离影响因素判断,掌握基础是关键,题目难度中等.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
2.有机物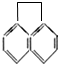 的一氯代物共有(不考虑立体异构)( )
的一氯代物共有(不考虑立体异构)( )
 的一氯代物共有(不考虑立体异构)( )
的一氯代物共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5 种 | D. | 7种 |
17.近期在西非国家爆发的埃博拉疫情已得到初步控制,已知该病毒对化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钠溶液、双氧水等消毒剂可以完全灭活病毒感染性,下列有关说法正确的是( )
| A. | 乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 高锰酸钾溶液和双氧水的消毒原理相同 | |
| C. | 双氧水具有较强的腐蚀性,不能用于清洗创口 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸 |
14.下列化学用语使用正确的是( )
| A. | 四氯化碳的电子式 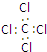 | B. | 乙炔的最简式 CH≡CH | ||
| C. | 聚乙烯的结构简式为 CH2=CH2 | D. | 丙烷的分子结构模型示意图 |
1.下列卤代烃一定能发生消去反应的是( )
| A. | 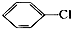 | B. | CH3CH2CH2Br | ||
| C. | 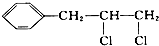 | D. | 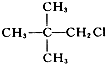 |
16.三联苯 的一氯代物有( ) 种同分异构体.
的一氯代物有( ) 种同分异构体.
 的一氯代物有( ) 种同分异构体.
的一氯代物有( ) 种同分异构体.| A. | 3 | B. | 4 | C. | 2 | D. | 5 |
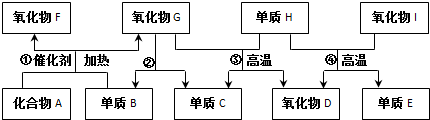
 .氧化物I中化学键类型:共价键.组成E单质的元素在元素周期表中的位置是第三周期第ⅣA族.图中物质所含元素原子的半径由大到小依次是(写元素符号)Si、C、N、O、H.
.氧化物I中化学键类型:共价键.组成E单质的元素在元素周期表中的位置是第三周期第ⅣA族.图中物质所含元素原子的半径由大到小依次是(写元素符号)Si、C、N、O、H. N2O4.
N2O4.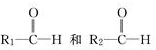 ;
;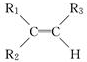 被氧化为
被氧化为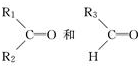 ,由此可判断分子式为C4H8的烯烃的氧化产物有( )
,由此可判断分子式为C4H8的烯烃的氧化产物有( )