题目内容
下列判断错误的是( )
| A、沸点:NH3>AsH3>PH3 |
| B、熔点:SiO2>CO2>CS2 |
| C、酸性:H2SO4>H3PO4>H2CO3 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.NH3分子之间存在氢键,故沸点相对较高;
B.SiO2是原子晶体,熔点很高,CO2和CS2是分子晶体;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
B.SiO2是原子晶体,熔点很高,CO2和CS2是分子晶体;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
解答:
解:A.NH3分子之间存在氢键,故沸点相对较高,故沸点:NH3>AsH3>PH3,故A正确;
B.SiO2是原子晶体,熔点很高,CO2和CS2是分子晶体,相对分子质量越大,熔点越高,故熔点:SiO2>CS2>CO2,故B错误;
C.非金属性:S>P>C,故最高价氧化物对应水化物的酸性:H2SO4>H3PO4>H2CO3,故C正确;
D.金属性:Na>Mg>Al,故最高价氧化物对应水化物的碱性:NaOH>Mg(OH)2>Al(OH)3,故D正确,
故选B.
B.SiO2是原子晶体,熔点很高,CO2和CS2是分子晶体,相对分子质量越大,熔点越高,故熔点:SiO2>CS2>CO2,故B错误;
C.非金属性:S>P>C,故最高价氧化物对应水化物的酸性:H2SO4>H3PO4>H2CO3,故C正确;
D.金属性:Na>Mg>Al,故最高价氧化物对应水化物的碱性:NaOH>Mg(OH)2>Al(OH)3,故D正确,
故选B.
点评:本题考查氢键的影响、晶体类型的判断、金属性与非金属性强弱与最高价氧化物对应水化物的酸性、碱性的关系,难度不大.要注意基础知识的积累.

练习册系列答案
相关题目
从反应结果分析,下列关于“反应先后顺序”的评价中正确的是( )
| A、向物质的量比为1:1的Na2CO3和NaOH混合溶液中通入少量CO2,NaOH先发生反应 |
| B、向体积比为1:1的SO2和CO2混合气体中加入少量氨水,CO2先发生反应 |
| C、向物质的量之比为1:1的FeCl3和CuCl2混合溶液中加入少量Fe粉,Cu2+先被还原 |
| D、向NH4Al(SO4)2溶液中滴加少量NaOH溶液,NH4+先发生反应 |
下列微粒的表示方法能确定为氧离子的是( )
| A、1S22S22p6 |
B、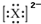 |
C、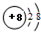 |
D、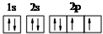 |
已知还原性Cl-<Fe2+<I-<SO2,则下列反应不能发生的是( )
| A、2Fe2++I2═2Fe3++2I- |
| B、I2+SO2+2H2O═H2SO4+2HI |
| C、2Fe3++2I-═2Fe2++I2 |
| D、Cl2+2Fe2+═2Fe3++2Cl- |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,48g O3含有氧原子数为NA |
| B、12g NaHSO4在熔融时离子总数为0.3NA |
| C、氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子 |
| D、7.8g Na2O2中含有阴离子数为0.1NA |
研究表明,SO2水溶液中存在着如下所示多个平衡,向该溶液中( )
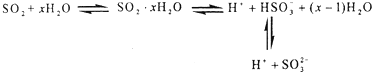
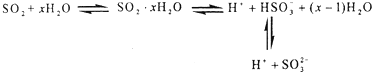
| A、滴加石蕊试液,先变红后褪色 |
| B、滴加品红溶液,先褪色后变红 |
| C、通入硫化氢气体,溶液pH先升高后降低 |
| D、加入足量氯化钡溶液,有白色沉淀生成 |
标况下,在五个烧瓶中分别充入①纯净的氨气②混有
空气的HCl③纯净的NO2④NO2与O2体积比4:1⑤NO与O2体积比4:3.然后做喷泉实验.实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
| 1 |
| 5 |
| A、①=②=③=④=⑤ |
| B、①=②=③>④>⑤ |
| C、①=②=③>⑤>④ |
| D、①>③>②>⑤>④ |
下列实验不能达到预期目的是( )
| A、用饱和NaHCO3溶液除去CO2中少量的HCl |
| B、用醋和澄清石灰水验证蛋壳中含有碳酸盐 |
| C、在试管中煮沸液体时,加碎石片可防止暴沸 |
| D、用硝酸酸化的氯化钡溶液检验某溶液中是否含有SO42- |
下列说法中正确的是( )
| A、分离Al2O3与Fe2O3混合物可以采取加入过量NaOH溶液充分反应后,过滤、洗涤、干燥 |
| B、用过量氨水除去Fe3+溶液中的少量Al3+ |
| C、将Mg(OH)2放入表面皿中,加入足量盐酸,加热蒸干得无水MgCl2 |
| D、Al(OH)3中混有Mg(OH)2;加入足量烧碱溶液,充分反应过滤,向滤液中通入足量二氧化碳后过滤、洗涤、干燥 |