题目内容
1.下列说法正确的是( )| A. | 周期表中从上至下,主族元素形成的单质熔沸点递增 | |
| B. | 同周期元素原子半径、离子半径递变规律相同 | |
| C. | HF、HCl、HBr、HI的熔沸点逐渐升高 | |
| D. | 含有离子键的化合物一定是离子化合物 |
分析 A、卤素元素形成的单质熔沸点自上而下逐渐升高,而碱金属元素形成的单质熔沸点自上而下逐渐降低;
B、决定微粒半径的最主要因素为电子层数,其次是核电荷数;
C、HF中存在氢键;
D、含有离子键的化合物一定由阴阳离子构成.
解答 解:A、卤素元素形成的单质熔沸点自上而下逐渐升高,而碱金属元素形成的单质熔沸点自上而下逐渐降低,与单质的类别、化学键等有关,故A错误;
B、决定微粒半径的最主要因素为电子层数,其次是核电荷数,同一周期的元素,从左到右,原子半径逐渐减小,而简单离子的半径并不是逐渐减小,故B错误;
C、HF中存在氢键,故HF的熔沸点反常的升高,比HCl、HBr、HI的熔沸点均高,故C错误;
D、含有离子键的化合物一定由阴阳离子构成,即只要含离子键一定为离子化合物,故D正确.
故选D.
点评 本题考查知识点较多,熟悉化学键、微粒半径的大小比较和氢键对物质熔沸点的影响,难度不大.

练习册系列答案
相关题目
9.下列各组物质中,一定互为同系物的是( )
| A. | C3H6和 C5H10 | B. | CH2=CH-CH3和CH3CH2CH2CH3 | ||
| C. | 甲烷与丙烷 | D. | 丁烷与异丁烷 |
16.下列说法正确的是( )
| A. | 已知30℃时Kw=3.80×10-14,则30℃时c(H+)=1.00×10-7mol/L的溶液是酸性的 | |
| B. | 正常成人胃液的pH=1.4,婴儿(体温与成人相同)胃液的pH=5.0,鉴于人的正常体温不是25℃,故两种胃液的c(OH-)不可能相差103.6倍 | |
| C. | 新制氯水中加入少量的NaHSO3晶体不会使c(HClO)增大 | |
| D. | 在熔融状态下,1molKHSO4完全电离出的阳离子数目为2NA |
6.下列有机物的化学式与名称对应不正确的是( )
| A. | 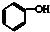 石炭酸 石炭酸 | B. |  TNT TNT | ||
| C. | CH3COOH 乙酸 | D. | CH2BrCH2Br 1,2-二溴乙烷 |
13.下列电子式正确的是( )
| A. | H2O2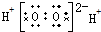 | B. | MgCl2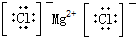 | C. | HClO  | D. | CCl4 |
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同位置的氢原子的核磁共振谱中给出的峰值(信号)也不同.根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同位置的氢原子的核磁共振谱中给出的峰值(信号)也不同.根据峰值(信号)可以确定有机物分子中氢原子的种类和数目. ;若取一定量的B完全燃烧后,生成3mol CO2和1.5mol H2O,则有39g烃B参加了反应,燃烧时消耗氧气3.75mol.
;若取一定量的B完全燃烧后,生成3mol CO2和1.5mol H2O,则有39g烃B参加了反应,燃烧时消耗氧气3.75mol.