题目内容
【题目】下表是元素周期表的一部分,回答下列问题。
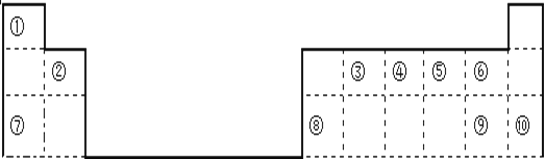
(1)⑨在周期表中的位置是__________________________;
(2)⑥对应的气态氢化物沸点高于同主族元素对应的气态氢化物,原因是______________;
(3)①⑤两元素可以形成原子个数比1︰1和2︰1的化合物X和Y,其中X的电子式为__________,用电子式表示Y的形成过程______________________________________;
(4)实验室制取④的最简单氢化物的化学反应方程式是:______________________________;
(5)由①③⑤三种元素组成的化合物之一Z,是生活中常见的有机化合物,它具有特殊的香味,写出Z发生催化氧化的反应方程式:_________________________________________________。
【答案】 第三周期ⅦA族 HF分子间存在氢键,氢键强于范德华力 ![]()
![]() Ca(OH)2 + 2NH4Cl
Ca(OH)2 + 2NH4Cl![]() CaCl2 + 2NH3↑ + 2H2O 2CH3CH2OH+O2
CaCl2 + 2NH3↑ + 2H2O 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】由元素周期表的结构可知:①为H元素、②为Be元素、③为C元素、④为N元素、⑤为O元素、⑥为F元素、⑦为Na元素、⑧为Al元素、⑨为Cl元素、⑩为Ar元素;
(1)⑨为氯元素,在周期表中的位置是 第三周期ⅦA族;
(2)HF的沸点高于同主族元素对应的气态氢化物,原因是 HF分子间存在氢键,氢键强于范德华力;
(3)H和O两元素可以形成原子个数比1︰1和2︰1的化合物H2O2和H2O,其中H2O2的电子式为![]() ,H2O为共价化合物,用电子式表示其形成过程为
,H2O为共价化合物,用电子式表示其形成过程为![]() ;
;
(4)实验室利用氯化铵和氢氧化钙混合加热制取氨气,发生反应的化学反应方程式为Ca(OH)2 + 2NH4Cl![]() CaCl2 + 2NH3↑ + 2H2O ;
CaCl2 + 2NH3↑ + 2H2O ;
(5)由H、C、O三种元素组成的化合物之一CH3CH2OH,是生活中常见的有机化合物,它具有特殊的香味,CH3CH2OH发生催化氧化生成CH3CHO的反应方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。