题目内容
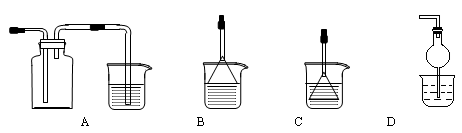
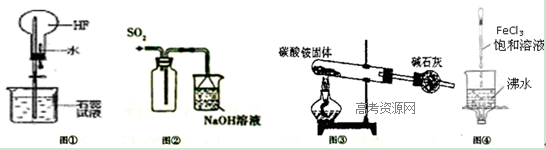
下列实验操作、现象(或数据)和结论正确的是( )。


B
试题分析:A.只有结构相似,在分子组成上相差一个或若干个CH2基团的有机物才是同系物,A错误;B.氯气能置换碘单质,碘在四氯化碳中的溶解度大于在水中溶解度,水和四氯化碳不互溶,且水的密度小于四氯化碳,所以滴加氯水和CCl4,振荡,静置,下层溶液显紫色,说明原溶液中有Γ,B正确;该选项不严谨,加氯水之前的溶液中可能含有碘单质;C.观察钾元素的焰色反应必须透过蓝色钴玻璃,滤去黄光的干扰,C错误;D.葡萄糖和新制氢氧化铜悬浊液反应生成砖红色沉淀必须在碱性条件下,所以酸性条件下的纤维素水解后的溶液中,必须先加氢氧化钠使溶液呈碱性,D错误;选B.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目