题目内容
孔雀石主要含Cu2(OH)2CO3,还含少量Fe的氧化物和SiO2,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:

试回答下列问题:
(1)B物质的化学式是 在未加入H2O2的溶液中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是 (填代号)。
(2)向溶液A加入H2O2的作用是 剂(填氧化或还原),离子反应方程式为 ,选用H2O2而不用Cl2的原因是 。
(3)由溶液C获得CuSO4·5H2O,需要经过 ,过滤等操作。除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器是 。
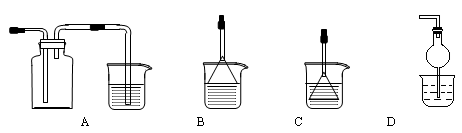
(4)制备CaCO3时,先通入 (填NH3或CO2),若实验过程中有氨气逸出,可选用下列装置中的 (填代号)装置吸收氨气。(烧杯中的液体都为水)

试回答下列问题:
(1)B物质的化学式是 在未加入H2O2的溶液中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是 (填代号)。
| A.KMnO4溶液 | B.Fe粉 | C.Na2CO3溶液 | D.KSCN溶液 |
(3)由溶液C获得CuSO4·5H2O,需要经过 ,过滤等操作。除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器是 。
(4)制备CaCO3时,先通入 (填NH3或CO2),若实验过程中有氨气逸出,可选用下列装置中的 (填代号)装置吸收氨气。(烧杯中的液体都为水)

(1)SiO2 (1分) , D(1分)
(2)氧化(1分) ,H2O2 + 2Fe2+ +2H+ = 2Fe3+ + 2H2O(2分) ,不引人新的杂质离子Cl-(2分)(3)蒸发浓缩,冷却结晶(1分);玻璃棒(1分)
(4)NH3(1分) BC(2分)
(2)氧化(1分) ,H2O2 + 2Fe2+ +2H+ = 2Fe3+ + 2H2O(2分) ,不引人新的杂质离子Cl-(2分)(3)蒸发浓缩,冷却结晶(1分);玻璃棒(1分)
(4)NH3(1分) BC(2分)
试题分析:(1)SiO2不溶于硫酸;Fe3+遇 KSCN溶液变成血红色,是Fe3+的特性,不会受到其他离子的干扰。(2)加入双氧水使二价铁离子转变为三价铁离子,最后以氢氧化铁形式析出;除去杂质的原则是不引入新的杂质。(3)溶液析出固体的实验操作。(4)制备CaCO3时会吸收气体,为防止倒吸,选用BC装置。

练习册系列答案
相关题目
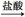 无明显现象
无明显现象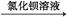 出现白色沉淀,说明样品中含SO42-
出现白色沉淀,说明样品中含SO42-
 N2O4△H>0
N2O4△H>0