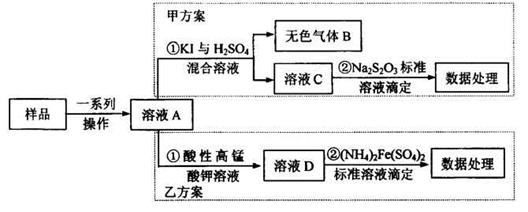
题目内容
硫酸亚铁铵是一种常用化学试剂,其晶体[(NH4)2Fe(SO4)2·6H2O]溶于水电离成简单离子,在乙醇中溶解度很小。
Ⅰ、硫酸亚铁铵晶体的制取
①用热的Na2CO3溶液洗涤除去铁屑表面油污;②用蒸馏水洗涤铁屑;③将铁屑溶于足量稀硫酸,过滤;④滤液中加入(NH4)2SO4固体,经溶解、蒸发结晶、过滤、洗涤、干燥得硫酸亚铁按晶体。
(1)用热的Na2CO3溶液除去油污的原理是 。
(2)铁屑因被空气氧化含少量Fe2O3,加稀H2SO4时Fe2O3会溶解产生少量Fe3+,但铁屑被H2SO4充分溶解后的溶液中并未检测出Fe3+,用离子方程式说明原因: 。
(3)步骤④中过滤得到的晶体表面含少量水,可用无水乙醇洗涤除去。需要用无水乙醇洗涤的理由是 。
Ⅱ.测定产品中各种离子含量
(4)称取ag产品,准确配制250mL溶液,取出25.00 mL溶液,加入足量BaCl2溶液,然后过滤、洗涤沉淀、烘干称重,得到bg沉淀。ag产品中含SO42—的物质的量为 mol。
(5)取(4)所配溶液25.00 mL放入锥形瓶,加入足量稀H2SO4,然后用0.1000mol·L—1,KMnO4溶 液滴定,终点时消耗20.00mL KMnO4溶液。滴定时反应的离子方程式(未配平)为: Fe2++ H++ MnO4—= Fe3++ Mn2++ H2O
①配平上述离子方程式,并标明电子转移的方向和总数。
②若上述数据只由一次滴定测得,某同学据此计算出ag产品中Fe2+含量为0.1mol。该同学得出结果的做法是否合理,请说明理由: 。
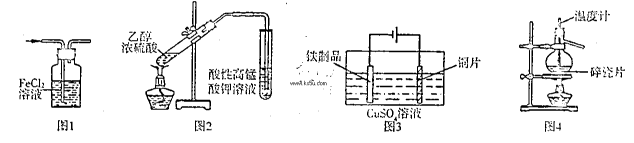
(6)另取ag产品,放入烧瓶中,加入足量NaOH溶液,产生气体用足量稀H2SO4吸收。实验前后稀H2SO4增重cg。实验装置如图。

结果表明按该方案测定NH4+的量时会产生较大误差,请对如 下两种情况的原因进行分析:
①NH4+测定结果偏高,原因可能 ;
②NH4+测定结果偏低,原因可能 。
Ⅰ、硫酸亚铁铵晶体的制取
①用热的Na2CO3溶液洗涤除去铁屑表面油污;②用蒸馏水洗涤铁屑;③将铁屑溶于足量稀硫酸,过滤;④滤液中加入(NH4)2SO4固体,经溶解、蒸发结晶、过滤、洗涤、干燥得硫酸亚铁按晶体。
(1)用热的Na2CO3溶液除去油污的原理是 。
(2)铁屑因被空气氧化含少量Fe2O3,加稀H2SO4时Fe2O3会溶解产生少量Fe3+,但铁屑被H2SO4充分溶解后的溶液中并未检测出Fe3+,用离子方程式说明原因: 。
(3)步骤④中过滤得到的晶体表面含少量水,可用无水乙醇洗涤除去。需要用无水乙醇洗涤的理由是 。
Ⅱ.测定产品中各种离子含量
(4)称取ag产品,准确配制250mL溶液,取出25.00 mL溶液,加入足量BaCl2溶液,然后过滤、洗涤沉淀、烘干称重,得到bg沉淀。ag产品中含SO42—的物质的量为 mol。
(5)取(4)所配溶液25.00 mL放入锥形瓶,加入足量稀H2SO4,然后用0.1000mol·L—1,KMnO4溶 液滴定,终点时消耗20.00mL KMnO4溶液。滴定时反应的离子方程式(未配平)为: Fe2++ H++ MnO4—= Fe3++ Mn2++ H2O
①配平上述离子方程式,并标明电子转移的方向和总数。
②若上述数据只由一次滴定测得,某同学据此计算出ag产品中Fe2+含量为0.1mol。该同学得出结果的做法是否合理,请说明理由: 。
(6)另取ag产品,放入烧瓶中,加入足量NaOH溶液,产生气体用足量稀H2SO4吸收。实验前后稀H2SO4增重cg。实验装置如图。

结果表明按该方案测定NH4+的量时会产生较大误差,请对如 下两种情况的原因进行分析:
①NH4+测定结果偏高,原因可能 ;
②NH4+测定结果偏低,原因可能 。
(14分)
(1)Na2CO3水解呈碱性,加热可增大其水解程度(2分)
(2)Fe+2Fe3+=3Fe2+ (2分)
(3)可减少晶体溶解损失,洗涤后晶体表面残留的乙醇易挥发除去 (2分)
(4)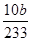 (2分)
(2分)
(5)①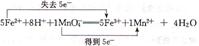 或
或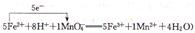
②不合理 (1分) 只滴定一次,偶然误差较大(或答应做2~3次平行的滴定实验,取平均值进行计算) (1分)
(6)①加热时水蒸气被稀H2SO4吸收(1分)
②实验结束装置中残留NH3未被稀H2SO4吸收(或倒置漏斗取出时沾附稀H2SO4) (1分,合理解释均可)
(1)Na2CO3水解呈碱性,加热可增大其水解程度(2分)
(2)Fe+2Fe3+=3Fe2+ (2分)
(3)可减少晶体溶解损失,洗涤后晶体表面残留的乙醇易挥发除去 (2分)
(4)
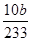 (2分)
(2分)(5)①
 或
或
②不合理 (1分) 只滴定一次,偶然误差较大(或答应做2~3次平行的滴定实验,取平均值进行计算) (1分)
(6)①加热时水蒸气被稀H2SO4吸收(1分)
②实验结束装置中残留NH3未被稀H2SO4吸收(或倒置漏斗取出时沾附稀H2SO4) (1分,合理解释均可)
试题分析:(1)碳酸钠溶液中CO32-水解使溶液显碱性,温度升高促进水解,碱性条件能促进油脂的水解而起到去污的目的。(2)Fe过量,Fe与Fe3+发生氧化还原反应。(3)晶体在乙醇中溶解度很小,乙醇属于易挥发的液体,可以带走晶体表面的水。(4)由SO42-~Ba2+关系知n(SO42-)=
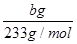 ×
×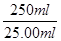 =
=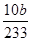 mol。(5)关于氧化还原反应离子方程式的配平,先根据得失电子守恒配平变价微粒,即n(MnO4-):n(Fe2+)=1:5,最后根据电荷守恒和质量守恒配平其他微粒的计量数。①双线桥的箭头是氧化剂指向还原产物,还原剂指向氧化产物,单线桥是还原剂指向氧化剂。
mol。(5)关于氧化还原反应离子方程式的配平,先根据得失电子守恒配平变价微粒,即n(MnO4-):n(Fe2+)=1:5,最后根据电荷守恒和质量守恒配平其他微粒的计量数。①双线桥的箭头是氧化剂指向还原产物,还原剂指向氧化产物,单线桥是还原剂指向氧化剂。
练习册系列答案
相关题目

 N2O4△H>0
N2O4△H>0