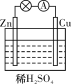
题目内容
【题目】(1)在一固定容积的密闭容器中发生反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下表所示:
T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为__________;
②该反应的正反应为__________反应(填“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是______(填字母代号)。
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa
⑥NH4Cl,其水溶液呈碱性的有________(填序号);常温下,0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是__________(填离子符号);
②判断Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填“>”“=”或“<”)。
(4)某电解装置如图所示。
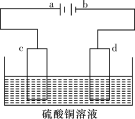
①当用惰性电极电解时,d电极的反应式为________________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量,发现两极质量差为16 g,则电路中转移的电子的物质的量为________mol。
【答案】![]() 放热 BC ②④⑤ 2 1×10-3 mol·L-1 Cu2+ < Cu2++2e-=Cu 0.25
放热 BC ②④⑤ 2 1×10-3 mol·L-1 Cu2+ < Cu2++2e-=Cu 0.25
【解析】
(1)①根据K的含义和化学方程式书写K;②结合平衡常数与温度的关系判断平衡移动方向,分析判断吸热放热;③化学平衡的标志是正逆反应速率相等,平衡混合物中各物质的含量不变;
(2)碱或强碱弱酸盐其溶液都呈碱性;pH=-lgc(H+);醋酸钠促进水电离,根据氢离子浓度结合水的离子积常数计算氢氧根离子浓度;
(3)生成沉淀需要的pH越小,则该离子先沉淀;先沉淀,说明溶度积小;
(4)①d与电源的负极相连,则d为阴极,溶液中的铜离子在阴极放电生成铜,电极反应为Cu2++2e-=Cu;
②根据阳极:Cu-2e-=Cu2+、阴极:Cu2++2e-=Cu, 两极质量差为16g,说明有8gCu参加反应,即转移电子物质的量为![]() ×2=0.25mol。
×2=0.25mol。
(1)①根据平衡常数的定义,此反应的平衡常数K=![]() ;
;
②化学平衡常数只受温度的影响,根据表格,温度升高,K降低,说明反应向逆反应方向进行,即此反应的正方向是放热反应;
③A、反应前后气体系数之和相等,压强不变,不能说明反应达到平衡;
B、根据化学平衡状态的定义,CO浓度不再改变说明反应达到平衡;
C、v正(H2)向正反应方向进行,v逆(H2O)向逆反应方向进行,且它们的速率之比等于化学计量数之比,说明反应达到平衡;
D、不知道开始时通入CO2和H2的量,因此两者浓度相等,不能说明反应达到平衡;
故答案为: ![]() ;放热;BC;
;放热;BC;
(2)①HCl的溶液显酸性;
②NaOH溶液显碱性;
③CH3COOH溶液显酸性;
④NH3·H2O溶液显碱性;
⑤CH3COONa是强碱弱酸盐,水溶液显碱性;
⑥NH4Cl属于强酸弱碱盐,水溶液显酸性;综上所述,溶液显碱性的是②④⑤;根据pH=-lgc(H+),0.01mol/LHCl溶液的c(H+)=0.01mol·L-1,即pH=2;水电离的一部分H+与CH3COO-结合生成CH3COOH,溶液中OH-完全是由水电离产生,即c(OH-)=Kw/c(H+)=10-14/10 -11mol·L-1=10-3mol·L-1;
故答案为:②④⑤;2;1×10-3 mol·L-1
(3)①这三个离子的水溶液显酸性,根据开始出现沉淀的pH,pH越小,加入NaOH溶液,最先出现沉淀,即Cu2+先沉淀;②先沉淀,说明溶度积小,因此Ksp[Fe(OH)2]<Ksp[Mg(OH)2];
故答案为: Cu2+;<;
(4)①d电极连接电源的负极,d电极为阴极,根据放电顺序,阴极电极反应式为Cu2++2e-=Cu;
②电镀时,铁作阴极,纯铜作阳极,阴极反应式为Cu2++2e-=Cu,阳极反应式为Cu-2e-=Cu2+,两极质量差为16g,说明有8gCu参加反应,即转移电子物质的量为![]() ×2=0.25mol。
×2=0.25mol。
故答案为:Cu2++2e-=Cu;0.25。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应![]() 正反应放热
正反应放热![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度 | 700 | 700 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的平衡转化率α |
|
|
|
平衡常数K |
|
|
|
下列说法正确的是![]()
![]()
A. ![]() ,
,![]() B.
B. ![]() ,
,![]()
C. ![]() ,
,![]() D.
D. ![]() ,
,![]()