题目内容
16.(1)工业上可利用“甲烷蒸气转化法”生产氢气,反应为甲烷和水蒸气在高温和催化剂存在的条件下生成一氧化碳和氢气,有关反应的能量变化如图1: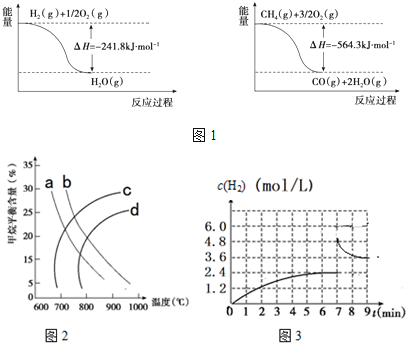
则该反应的热化学方程式CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol.
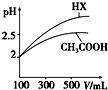
(2)已知温度、压强对甲烷平衡含量的影响如图2,请回答:
①图2中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是a.
②该反应的平衡常数:600℃时<700℃(填“>”“<”或“=”).
③已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6min达到平衡(如图3),此时CH4的转化率为80%,该温度下反应的平衡常数为276.5mol2•L-2(结果保留小数点后一位数字).
④从图3分析,由第一次平衡到第二次平衡,平衡移动的方向是向逆反应方向(填“向正反应方向”或“向逆反应方向”),采取的措施可能是将容器体积缩小为原来的$\frac{1}{2}$或加入等量的氢气.
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中铵根离子浓度逐渐增大.写出该电池的正极反应式:N2+6e-+8H+═2NH4+.
分析 (1)由图1可知:①H2(g)+$\frac{1}{2}$O2(g)→H2O(g)△H=-241.8kJ/mol;
②CH4(g)+$\frac{3}{2}$O2(g)→CO(g)+2H2O(g)△H=-564.3kJ/mol;
由盖斯定律可知,②-3×①得CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H;
(2)①由CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,甲烷的平衡含量会逐渐减小,因此排除曲线c、d,又因增大压强,平衡逆向移动,甲烷的平衡含量增大,故1Mpa是曲线a,2Mpa的是曲线b;
②由CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,平衡常数增大;
③CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)
起始(mol/L):1 1 0 0
变化(mol/L):0.8 0.8 0.8 2.4
平衡(mol/L):0.2 0.2 0.8 2.4
此时CH4的转化率为$\frac{0.8}{1}$×100%=80%;
该温度下反应的平衡常数K=$\frac{0.8mol/L×(2.4mol/L)^{3}}{0.2mol/L×0.2mol/L}$=276.5mol2•L-2;
④由图3可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的$\frac{1}{2}$或增加了等量的氢气,平衡均是逆向移动;
(3)该燃料电池,氢气在负极失去电子生成氢离子,溶液中铵根离子浓度逐渐增大,说明氮气在正极得到电子后与氢离子结合生成NH4+.
解答 解:(1)由图1可知:①H2(g)+$\frac{1}{2}$O2(g)→H2O(g)△H=-241.8kJ/mol;
②CH4(g)+$\frac{3}{2}$O2(g)→CO(g)+2H2O(g)△H=-564.3kJ/mol;
由盖斯定律可知,②-3×①得CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=-564.3kJ/mol-3×(-241.8kJ/mol)=+161.1kJ/mol,
故答案为:CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol;
(2)①由CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,甲烷的平衡含量会逐渐减小,因此排除曲线c、d,又因增大压强,平衡逆向移动,甲烷的平衡含量增大,故1Mpa是曲线a,2Mpa的是曲线b,
故答案为:a;
②由CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)△H=+161.1kJ/mol可知,随着温度的升高,平衡向正反应方向移动,平衡常数增大,因此该反应的平衡常数:600℃时小于700℃,
故答案为:<;
③CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)
起始(mol/L):1 1 0 0
变化(mol/L):0.8 0.8 0.8 2.4
平衡(mol/L):0.2 0.2 0.8 2.4
此时CH4的转化率为$\frac{0.8}{1}$×100%=80%;
该温度下反应的平衡常数K=$\frac{0.8mol/L×(2.4mol/L)^{3}}{0.2mol/L×0.2mol/L}$=276.5mol2•L-2;
故答案为:80%;276.5mol2•L-2;
④由图3可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的$\frac{1}{2}$或增加了等量的氢气,无论是增大压强,还是增大氢气的浓度,平衡均是逆向移动,
故答案为:向逆反应方向;将容器体积缩小为原来的$\frac{1}{2}$或加入等量的氢气;
(3)该燃料电池,氢气在负极失去电子生成氢离子,溶液中铵根离子浓度逐渐增大,说明氮气在正极得到电子后与氢离子结合生成NH4+,则正极反应式为:N2+6e-+8H+=2NH4+,
故答案为:N2+6e-+8H+=2NH4+.
点评 本题考查了盖斯定律的应用、化学平衡影响因素和化学平衡常数以及转化率的计算、燃料电池的电极反应式的书写,综合性较强,为历年高考高频考点,侧重于化学反应原理和图象分析能力的培养,题目难度中等.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | CH3COONa溶液与HCl溶液混合所得的中性溶液中:c(Na+)>c(Cl-) | |
| C. | Na2S和NaHS的混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| D. | pH=8的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(OH-) |
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
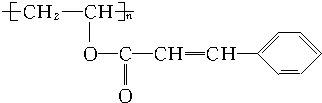
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
| A. | V1:V2的值 | B. | V1和V2的值 | ||
| C. | X和Y的物质的量 | D. | 盐酸和稀硫酸的物质的量浓度 |
| A. | NaNO2发生氧化反应 | |
| B. | NH4Cl 中的氮元素被还原 | |
| C. | N2既是氧化产物,又是还原产物 | |
| D. | 每生成1mol N2转移电子的物质的量为6mol |
| A. | BOH的电离方程式是BOH═B++OH- | |
| B. | 将一定体积的上述两种溶液混合后得到中性溶液,则V(HA)<V(BOH) | |
| C. | 在0.1 mol•L-1BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+) | |
| D. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1,则溶液的pH=9 |
 .
.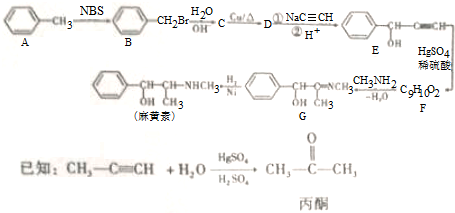

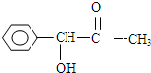 ,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种)
,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种) 或
或 .
.