题目内容
【题目】请完成下列填空:
(1)当NH3和N2H4所含分子数之比为1∶1时,其所含原子数之比为____,质量之比为____。
(2)现有m g某气体A,其摩尔质量为M g·mol-1。
①气体A在标准状况下的体积为____L
②A溶于水后形成V L溶液(A与水不反应),所得溶液的物质的量浓度为____ mol·L-1。
(3)将a mL 2 mol·L-1的Mg(NO3)2溶液稀释至b mL,稀释后溶液中NO3-的物质的量浓度为____mol/L
(4)一定体积的0.2 mol·L-1的BaCl2溶液,可使相同体积的Na2SO4溶液、KAl(SO4)2溶液、Fe2(SO4)3溶液3种溶液中的SO42-完全沉淀,则上述3种硫酸盐溶液的物质的量浓度比为____。
【答案】2∶3 17∶32 ![]()
![]()
![]() 6∶3∶2
6∶3∶2
【解析】
(1)当NH3和N2H4中分子个数比为1:1 时,原子总数之比为:1×4:1×6=2:3;质量之比为:1×17:1×32=17:32;
(2)①mg该气体的物质的量为:n=![]() =
=![]() mol,在标准状况下的体积为:V=n×22.4L/mol=22.4L/mol×
mol,在标准状况下的体积为:V=n×22.4L/mol=22.4L/mol×![]() mol=
mol=![]() L;
L;
②A溶于水后形成V L溶液(A与水不反应),所得溶液的物质的量浓度c=![]() =
=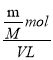 =
=![]() mol·L-1;
mol·L-1;
(3)先由稀释定律计算稀释后c[Mg(NO3)2] =![]() mol/L,再由溶质电离方程式Mg(NO3)2= Mg2++2NO3-可知,c(NO3-) = 2 c[Mg(NO3)2] =
mol/L,再由溶质电离方程式Mg(NO3)2= Mg2++2NO3-可知,c(NO3-) = 2 c[Mg(NO3)2] =![]() mol/L;
mol/L;
(4)要使同体积同浓度的BaCl2溶液中钡离子完全沉淀,则消耗Na2SO4、KAl(SO4)2、Fe2(SO4)3三种溶液中的SO42-的物质的量相等,三种溶液体积相等,则三种溶液中硫酸根离子的浓度相等,Na2SO4、KAl(SO4)2、Fe2(SO4)3中SO42-个数之比为1:2:3,要使硫酸根离子浓度相等,则这三种盐溶液的浓度之比为6:3:2。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案