题目内容
11.按要求写出下列反应方程式(请注明反应条件),并按要求填空(1)实验室制备乙烯CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O,反应类型是消去反应.
(2)乙酸与乙醇的反应CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,反应过程中乙酸断裂的是碳氧键,乙醇断裂的是氧氢键.
(3)2-溴丙烷与氢氧化钠水溶液共热CH3CHBrCH3+NaOH$\stackrel{△}{→}$CH3CHOHCH3+NaBr,
此反应将卤代烃类物质转化为醇类物质.
(4)苯与浓硫酸、浓硝酸的混合酸在100~110℃时发生取代反应
 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$ +2H2O.
+2H2O.
分析 (1)乙醇发生消去反应生成乙烯;
(2)在浓硫酸作催化剂条件下加热乙醇和乙酸发生酯化反应生成乙酸乙酯;
(3)根据卤代烃消去的条件解答,2-溴丙烷与NaOH水溶液发生取代反应生成丙醇;
(4)苯与浓硝酸浓硫酸混合共热制取硝基苯,苯环上的H被硝基取代,苯与浓硝酸、浓硫酸的混合物在100~110℃时发生取代反应生成间-二硝基苯;
解答 解:(1)乙醇发生消去反应生成乙烯,反应为CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O,发生的反应是消去反应,故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O;消去反应;
(2)在浓硫酸作催化剂条件下加热乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,反应过程中乙酸断裂的是碳氧键,乙醇断裂的是氢氧键,故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;碳氧;氧氢;
(3)卤代烃在碱性水溶液加热条件下发生取代反应,由2-溴丙烷变成2-丙醇,方程式为CH3CHBrCH3+NaOH$\stackrel{△}{→}$CH3CHOHCH3+NaBr,此反应将卤代烃类物质转化为醇类物质,
故答案为:CH3CHBrCH3+NaOH$\stackrel{△}{→}$CH3CHOHCH3+NaBr,醇;
(4)苯与浓硝酸、浓硫酸的混合物在100~110℃时发生取代反应生成间-二硝基苯,反应的方程式为 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为: +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$ +2H2O.
+2H2O.
点评 本题考查有机反应的化学方程式的书写,掌握常见有机物的性质是解答的关键,该题易错点为卤代烃取代和消去反应的条件,题目难度中等.


| A. | 途径① | B. | 途径② | C. | 途径③ | D. | 途径④ |
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶 液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度 (mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol/L 醋酸的pH大于2
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大(填“增大”、“减小”或“不变”).
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:用pH计测定相同浓度的醋酸在几种不同温度时的pH.
| A. | 熔点:金刚石>食盐>干冰 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 离子半径:Na+<Mg2+<Al3+ |
| A. | X、Y、Z的物质的量之比为1:3:2 | |
| B. | X、Y、Z的浓度不再发生变化 | |
| C. | 单位时间内生成2n mol Z,同时消耗3n mol Y | |
| D. | 单位时间内消耗n mol X,同时消耗3n mol Y |
| A. | 溴乙烷与氢氧化钠水溶液共热 | |
| B. | 溴乙烷与氧氧化钠的乙醇溶液共热 | |
| C. | 甲烷与氯气反应 | |
| D. | 乙炔与氯化氢在一定条件下制氯乙烯 |
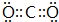 ;
; ;
;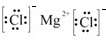 .
.