题目内容
4.X、Y、Z是短周期的三种相邻元素,X和Y在同一周期,Y和Z在同一主族,这三种元素原子的最外层电子数之和为19,且原子序数之和为41,则X、Y、Z的元素符号分别为( )| A. | N、O、S | B. | Cl、S、O | C. | Si、P、N | D. | S、Cl、F |
分析 X、Y、Z是周期表中相邻的三种元素,其中X、Y在同一周期,Y、Z在同一主族,且这三种元素原子最外层电子数之和为19,质子数总和为41,根据三种元素的最外层电子数之和确定三种元素的主族序数,再结合其质子数总数确定元素,由此分析解答.
解答 解:X、Y、Z是周期表中相邻的三种元素,其中X、Y在同一周期,Y、Z在同一主族,且这三种元素原子最外层电子数之和为19,质子数总和为41,设Z、Y的最外层电子数是a,X的最外层电子数是a+1,a+a+a+a+1=19,a=6,所以Y和Z属于第VIA族元素、X属于第VIⅠA族元素,质子数总和为41,设Z的质子数是b、Y的质子数是b+8,X的质子数是b+9,b+b+8+b+9=38,所以b=8,所以Z是O元素、Y是S元素、X是Cl元素,
故选B.
点评 本题考查了原子结构和元素性质,明确原子结构、元素周期表结构是解本题关键,再根据最外层电子数、质子数来确定元素,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
13.下列根据实验操作和实验现象所得出的结论,正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向2mL 2%CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后滴加M溶液,加热 | 未出现砖红色沉淀 | M中不含醛基 |
| B | 在CuSO4溶液中介入KI溶液,再加入苯,振荡后静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| C | 向有机试剂N中加入2mL5%的NaOH溶液,加热,冷却后取上层溶液滴加几滴AgNO3溶液 | 出现褐色沉淀 | N不是卤代烃 |
| D | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2已氧化变质 |
12.如图所示装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )


| A. | 若a为浓硫酸,b为Na2SO3固体,c中盛紫色石蕊溶液,则c中溶液变红 | |
| B. | 若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 | |
| C. | 若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液褪色 | |
| D. | 若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
19.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为0.2000mol/L(保留小数点后四位).
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol/L 醋酸的pH大于2
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大(填“增大”、“减小”或“不变”).
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:用pH计测定相同浓度的醋酸在几种不同温度时的pH.
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶 液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度 (mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol/L 醋酸的pH大于2
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大(填“增大”、“减小”或“不变”).
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:用pH计测定相同浓度的醋酸在几种不同温度时的pH.
9.下列物质中属于芳香醇的是( )
| A. | 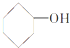 | B. |  | C. |  | D. | CH3CH2OH |
16.下列各组顺序的排列不正确的是( )
| A. | 熔点:金刚石>食盐>干冰 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 离子半径:Na+<Mg2+<Al3+ |
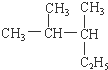 2,3-二甲基戊烷
2,3-二甲基戊烷
 )广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线:
)广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线: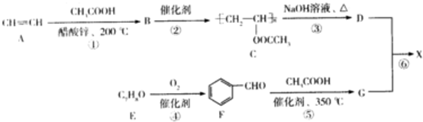

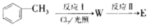
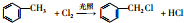 ,反应Ⅱ的试剂为氢氧化钠水溶液、加热.
,反应Ⅱ的试剂为氢氧化钠水溶液、加热.
 ,E的化学式为NO.
,E的化学式为NO.