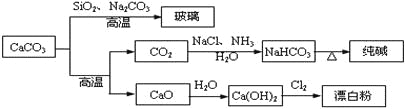
题目内容
【题目】向四个相同容积的密闭容器中分别充入一定量的CO、H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g)。开始反应时,按正反应速率由大到小的顺序排列,正确的是
CH3OH(g)。开始反应时,按正反应速率由大到小的顺序排列,正确的是
①在500℃时,5 mol CO和10 mol H2反应
②在500℃时,加入催化剂,10 mol H2与5 mol CO反应
③在450℃时,6 mol H2和3 mol CO反应
④在500℃时,6 mol H2和3 mol CO反应
⑤在450℃时,4 mol H2和2 mol CO反应
A.②①③④⑤B.②①④③⑤C.⑤②①③④D.②④⑤③①
【答案】B
【解析】
影响化学反应速率的因素,最大的是催化剂,其次是温度,然后是浓度。在温度相同时,催化剂对化学反应速率影响最大,所以速率最快的是②,在温度相同时,物质的浓度越大,速率越快,温度越高,反应速率越快,所以化学反应速率:②>①>④>③>⑤,故合理选项是B。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
【题目】已知还原性:![]() 某无色溶液中只可能含有
某无色溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的部分离子,进行下列实验:通过实验得出的结论正确的是
中的部分离子,进行下列实验:通过实验得出的结论正确的是![]()
实验编号 | 操作 | 现象 |
| 取10mL溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 | 生成无色气体、上层为紫色 |
| 向 | 可得到白色沉淀 |
| 取10mL原溶液,加入过量的NaOH溶液并加热 | 产生448L气体 |
A.实验![]() 中若通入过量的
中若通入过量的![]() ,则先后氧化了
,则先后氧化了![]() 、
、![]()
B.上述3个实验不能确定是否一定含有![]() ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有
,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有![]()
C.判断溶液中是否含有钾离子,不需要通过焰色反应来检验
D.实验![]() 能够确定溶液中不含有
能够确定溶液中不含有![]()