题目内容
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO,下列叙述不正确的是
H++CH3COO,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.0.10 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)增大。
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸。
【答案】D
【解析】
A. 醋酸的电离是吸热过程,升高温度,平衡正向移动,电离平衡常数增大,故A正确;
B. 加水稀释溶液的酸性减弱,则c(OH-)增大,故B正确;
C. 醋酸钠晶体会电离出CHCOO-,使电离平衡CH3COOH![]() H++CH3COO逆向移动,故C正确;
H++CH3COO逆向移动,故C正确;
D. 温度不变则电离常数不变,故D错误;
故答案为D。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成__________而使Cu2O产率降低。
(2)已知:①2Cu(s)+ ![]() O2(g)=Cu2O(s) ΔH1=-169 kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169 kJ·mol-1
②C(s)+ ![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+ ![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=________。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
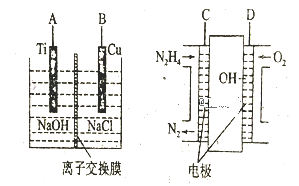
①上述装置中B电极应连_________电极(填“C”或“D”)。
②该离子交换膜为____离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为_______。
③原电池中负极反应式为______________。
【题目】Ⅰ. 在容积为5L的密闭容器中,通入5 mol N2和8 mol H2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 mol NH3。则:
(1)2 min时,容器内n(N2)=________ ,c(H2)=___________。
(2)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为 _______。
Ⅱ.在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行