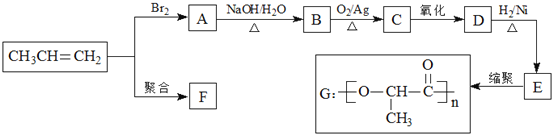
题目内容
【题目】下图是利用盐桥电池从某些含碘物质中提取碘的两个装置

下列说法中正确的是( )
A.两个装置中,石墨I和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.装置①、②中的反应生成等量的I2时,导线上通过的电子数之比为1∶5
D.装置①中MnO2的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
【答案】C
【解析】
A.两个装置中,①中左边碘离子化合价升高变为单质碘,因此石墨I作负极,②中左边碘酸根离子化合价降低变为单质碘,因此石墨Ⅱ作正极,故A错误;
B.碘元素在装置①中化合价升高,被氧化,在装置②中化合价降低,被还原,故B错误;
C.装置①、②中的反应生成1mol的I2时,导线上通过的电子数物质的量分别为2mol和10mol,导线上通过的电子数之比为1∶5,故C正确;
D.装置①中MnO2的电极反应式应该为MnO2+4H++2e-=Mn2++2H2O,故D错误。
综上所述,答案为C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目