题目内容
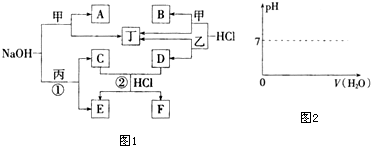
18.在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂,F是地壳中含量最多的金属元素.(反应中生成的水和部分反应条件未列出)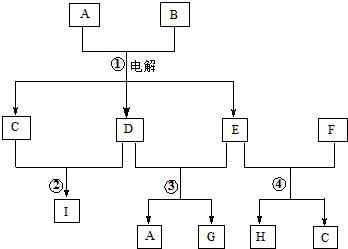
(1)画出A中阴离子的结构示意图
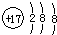 .
.(2)反应②在点燃条件下的现象是安静燃烧、苍白色火焰、产生白雾.
(3)E中的化学键为离子键、共价键
(4)H转化为F的氢氧化物最好选择的试剂是CO2.
(5)反应③的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(6)反应④的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 A是海水中含量最丰富的盐,则A为NaCl,B是常见的无色液体,电解A、B生成C、D、E,可以推知B为H2O,而D与E反应生成A(NaCl)与G,G的水溶液是一种常用的漂白剂,可推知G为NaClO,该反应是氯气与NaOH反应,故C为H2,D能与氢气、氯气都反应,故D为Cl2、E为NaOH,可推知I为HCl.F是地壳中含量最多的金属元素,则F为Al,与NaOH反应生成偏铝酸钠与氢气,则H为NaAlO2,
(1)A为NaCl,其阴离子是氯离子,氯离子三个电子层,最外层8个电子;
(2)氢气在氯气中安静的燃烧,放出苍白色火焰;
(3)氢氧化钠为离子化合物,钠离子和氢氧根离子间是离子键,氢氧根离子内存在共价键;
(4)氢氧化铝溶于强酸,故偏铝酸钠转化为氢氧化铝最好选择的试剂是弱酸,可以通入二氧化碳;
(5)反应③是氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(6)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
解答 解:A是海水中含量最丰富的盐,则A为NaCl,B是常见的无色液体,电解A、B生成C、D、E,可以推知B为H2O,而D与E反应生成A(NaCl)与G,G的水溶液是一种常用的漂白剂,可推知G为NaClO,该反应是氯气与NaOH反应,故C为H2,D能与氢气、氯气都反应,故D为Cl2、E为NaOH,可推知I为HCl.F是地壳中含量最多的金属元素,则F为Al,与NaOH反应生成偏铝酸钠与氢气,则H为NaAlO2,
(1)A为NaCl,其阴离子是氯离子,氯离子三个电子层,最外层8个电子,其结构示意图为: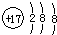 ,
,
故答案为: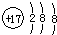 ;
;
(2)反应②在点燃条件下的现象是:安静燃烧、苍白色火焰、产生白雾,
故答案为:安静燃烧、苍白色火焰、产生白雾;
(3)氢氧化钠是离子化合物,氢氧根离子中含有共价键;
(4)氢氧化铝溶于强酸,故偏铝酸钠转化为氢氧化铝最好选择的试剂是:CO2,
故答案为:CO2;
(5)反应③的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)反应④的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查无机物推断,涉及Cl、Al元素单质化合物性质及氯碱工业等,难度不大,注意对基础知识的全面掌握.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | $\frac{1}{2}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{3}$ | D. | $\frac{3}{8}$ |
| A. | 钠熔化,浮在液面上四处游动 | B. | 有气体产生 | ||
| C. | 溶液中产生蓝色絮状沉淀 | D. | 溶液中析出红色的铜 |
| A. | 青石棉是一种硅酸盐材料 | |
| B. | 青石棉能完全溶于足量硝酸中,得到澄清透明溶液 | |
| C. | 青石棉的化学组成可表示为Na2O•3FeO•Fe2O3•8SiO2•H2O | |
| D. | 1 mol青石棉能还原1 mol HNO3的稀硝酸 |
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | X与W形成的化合物中只含离子键 | |
| C. | W的氢化物的沸点一定高于Z的氢化物 | |
| D. | 若W与Y的原子序数相差5,则两者形成的化合物的化学式一定为Y2W3 |
| 实验操作 | 灯泡亮度变化 |
| 通入CO2以前 | 亮 |
| 开始通入CO2时 | 亮变暗 |
| 恰好完全沉淀 | 至全暗 |
| 沉淀完全后,继续通入过量的CO2 | 暗变亮 |
| 再通入CO2 | 不变 |


 ;反应②的离子方程式为ClO-+2Fe2++2H+=Cl-+2Fe3++H2O.
;反应②的离子方程式为ClO-+2Fe2++2H+=Cl-+2Fe3++H2O.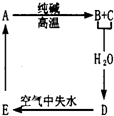 物质A是一种高熔点化合物,不溶于H2SO4、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀;E是白色固体.A、B、C、D、E之间的转化如图,试推断:
物质A是一种高熔点化合物,不溶于H2SO4、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀;E是白色固体.A、B、C、D、E之间的转化如图,试推断: