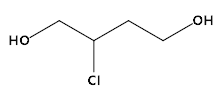
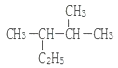题目内容
【题目】CO、SO2是大气污染气体,利用化学反应是治理污染的重要方法。
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇:CO+2H2![]() CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。

(1)下列能说明反应达到平衡状态的是_______(填序号)。
①v逆(CO)=2v正(H2)
②c(CO)=c(CH3OH)
③混合气体的平均相对分子质量不变
④单位时间内生成2n mol H2的同时生成n mol CH3OH
(2)该反应在A点的平衡常数K_________(用a和V表示)。
(3)写出既能增大v(CO)又能提高CO转化率的一项措施:________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
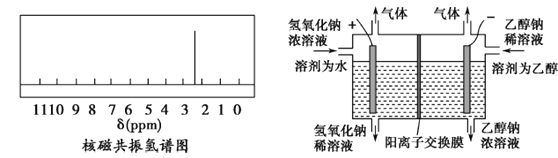
(4)原电池原理:该小组设计的原理示意图(如图1所示),写出该电池正极的电极反应式_______。

(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸(原理如图2所示)。写出开始电解时阳极的电极反应式_______。
Ⅲ.硫代硫酸钠(Na2S2O3)俗称大苏打,有着广泛的用途。用SO2可制Na2S2O3。某小组同学制备、预测并探究硫代硫酸钠的性质(反应均在溶液中进行)。
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | 把pH试纸放在玻璃片上,用玻璃棒蘸取溶液滴在试纸上 | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 黄绿色颜色变浅,甚至褪去 |
(6)分析SO2能制备Na2S2O3的理论依据是_________。
(7)用离子方程式表示Na2S2O3溶液具有碱性的原因_________。
(8)探究2反应的离子方程式为_________。
【答案】③④ ![]() 压缩体积或增大体积压强 O2+4e-+4H+=2H2O HSO3-+H2O-2e-=SO42-+3H+ 从氧化还原反应角度分析,SO2中S元素化合价为+4,Na2S2O3中S元素化合价为+2,S的化合价降低,加入合适的还原剂如S等就能实现转化 S2O32-+H2O
压缩体积或增大体积压强 O2+4e-+4H+=2H2O HSO3-+H2O-2e-=SO42-+3H+ 从氧化还原反应角度分析,SO2中S元素化合价为+4,Na2S2O3中S元素化合价为+2,S的化合价降低,加入合适的还原剂如S等就能实现转化 S2O32-+H2O![]() HS2O3-+OH- S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-
HS2O3-+OH- S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-
【解析】
(1)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(2)该反应的平衡常数K=![]() ,利用物质反应转化关系将A点时各物质的平衡浓度代入表达式中可得;
,利用物质反应转化关系将A点时各物质的平衡浓度代入表达式中可得;
(3)影响反应速率的因素有温度、浓度、压强和催化剂,影响平衡移动的因素有温度、浓度和压强,提高CO转化率,应使平衡正向移动;
II.(4)依据原电池原理,负极是失电子发生氧化反应,二氧化硫失电子生成硫酸的过程;
(5)根据化合价变化判断阳极反应物质,写出阳极反应式;
III.(6)分析SO2和Na2S2O3中S元素化合价变化情况,说明SO2制备Na2S2O3时加入合适的还原剂如S或Na2S时即可实现转化;
(7)Na2S2O3是强碱弱酸盐,水解显碱性;
(8)验证Na2S2O3具有还原性,通过观察新制氯水的变色情况验证,所以氯水颜色变浅,甚至褪去,说明Na2S2O3发生氧化反应。
I.(1)①2v逆(CO)=v正(H2)说明反应达到平衡状态,但v逆(CO)= 2v正(H2)v说明反应逆向进行,①错误;
②c(CO)=c(CH3OH)时反应可能处于平衡状态,也可能未处于平衡状态,不能说明正、逆反应速率关系,不能据此判断反应是否处于平衡状态,②错误;
③该反应是气体体积不相等的反应,所以混合气体的平均相对分子质量不变,说明气体的总物质的量不变,反应达到平衡状态,③正确;
④单位时间内生成2n mol H2的同时生成n mol CH3OH,说明v逆(H2)=2v正(CH3OH),说明反应达到平衡状态,④正确;
故合理选项是③④;
(2)对于反应CO+2H2![]() CH3OH(g),反应开始时n(CO)=a mol,n(H2)=2a mol,A点达到平衡时CO转化率为75%,则反应的CO的物质的量为a mol×75%=0.75a mol,反应的H2的物质的量是0.75a mol×2=1.5a mol,反应产生CH3OH的物质的量为0.75a mol,则平衡时各种气体的物质的量为n(CO)=a mol-0.75a mol=0.25a mol,n(H2)=2a mol-1.5a mol=0.5a mol,n(CH3OH)=0.75amol,由于容器的容积为V L,所以在该条件下,反应的化学平衡常数K=
CH3OH(g),反应开始时n(CO)=a mol,n(H2)=2a mol,A点达到平衡时CO转化率为75%,则反应的CO的物质的量为a mol×75%=0.75a mol,反应的H2的物质的量是0.75a mol×2=1.5a mol,反应产生CH3OH的物质的量为0.75a mol,则平衡时各种气体的物质的量为n(CO)=a mol-0.75a mol=0.25a mol,n(H2)=2a mol-1.5a mol=0.5a mol,n(CH3OH)=0.75amol,由于容器的容积为V L,所以在该条件下,反应的化学平衡常数K=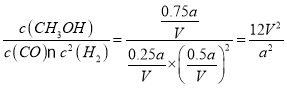 ;
;
(3)既能增大v(CO)又能提高CO转化率,应使平衡正向移动,由于正反应放热,则应采取压缩容器的体积或增大体积压强的方法;
II.(4)该原电池中,负极上SO2失电子被氧化生成硫酸,正极上O2得到电子被还原,与溶液中的H+结合生成H2O,所以正极上的电极反应式为O2+4e-+4H+=2H2O;
(5)电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+;
III.(6)SO2→Na2S2O3中S元素化合价由+4→+2,化合价降低,根据氧化还原反应规律可知:加入还原性的物质如如S或Na2S等,就能实现SO2→Na2S2O3的转化;
(7)Na2S2O3是强碱弱酸盐,S2O32-水解消耗水电离产生的H+,最终达到平衡时溶液中c(OH-)>c(H+),所以溶液显碱性,H![]() HS2O3-+OH-;
HS2O3-+OH-;
(8)新制氯水的主要成分为Cl2,Cl2氧化S2O32-生成SO42-,Cl2得到电子被还原为Cl-,使氯水颜色变浅,甚至褪去,所以离子方程式为S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-。

【题目】实验室从含碘废液(含有H2O 、CCl4、I2、I-等)中回收碘,操作过程如下:
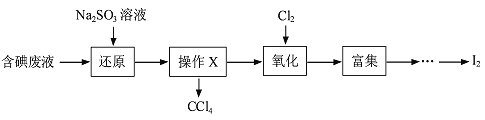
(1)向废液中加入Na2SO3溶液,发生“还原”反应的离子方程式为____________。
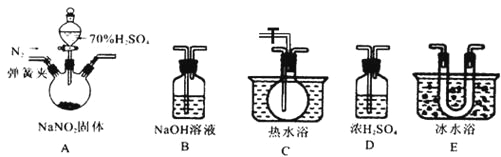
(2)“氧化”操作在三颈烧瓶中进行(如图一),将溶液用盐酸调至pH约为2,缓慢通入Cl2。实验用水浴控制在40℃左右的较低温度下进行的原因是_______。
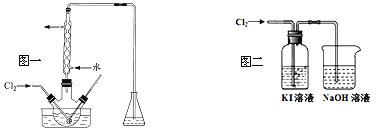
(3)某研究小组用图二装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
假设一:没有I2形态;假设二:没有I-形态;假设三:有IO3-形态。
①请设计实验证明假设一成立(试剂自选)。
实验操作 | 预期现象 | 结论 |
___________________ | 假设一成立 |
②若假设三成立,请写出生成IO3-的离子方程式__________________________________。
(4)该研究小组还进行了对加碘盐中KIO3含量测定的如下实验:
①准确称取加碘盐m g于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成250.00mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉试液,用c molL-1Na2S2O3标准液滴定至终点,重复3次,测得平均值为V mL。
已知:IO3-+ 5I-+6H+ =3H2O+3I2,I2 +2S2O32-=2I-+S4O62-。测定时,判断达到滴定终点的现象为___________。由测定数据可求得该样品中含KIO3的质量分数为___________(用含m、c、V的代数式表示,Mr(KIO3)=214 )。
②在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因_______________________。