题目内容
【题目】碳元素是形成物种最多的元素之一,其中许多物质对人类来说有着极其重要的作用。

(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,它是世界上最薄却也是最坚硬的纳米材料,同时也是导电性最好的材料(结构如图)。下列物质可能与它反应的是_____(填字母)。
A.氧气 B.单质氟 C.浓硝酸 D.氢氧化钠溶液
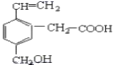
(2)另一含碳化合物,其分子式为C3H6S2O,它是一种重要医药中间体,它的核磁共振氢谱见下图左。则它的结构简式为_________。
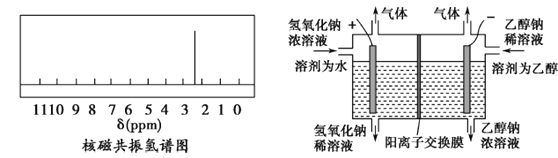
(3)某科研组设计如上图装置,利用电解乙醇和氢氧化钠制取乙醇钠(阳离子交换膜只允许Na+通过)。电解时阳极生成的气体是_________,阴极发生的电极反应式为_________。
【答案】ABC ![]()
![]()
![]()
【解析】
(1)石墨烯是碳的单质,根据碳单质的性质,石墨烯可以与氧气、浓硝酸、氟气发生反应,不能氢氧化钠反应;
(2)根据核磁共振氢谱图,可知该物质中含有一种类型的氢原子,具有完全对称结构;
(3)电解乙醇和氢氧化钠,制取乙醇钠,电解时阳极是氢氧根离子失电子发生氧化反应的过程,产生氧气,阴极上是乙醇中的羟基氢原子得电子的还原反应。
(1)根据碳单质的性质,在点燃条件下能与氧气反应,加热条件下能与浓硝酸反应,碳单质也可以与氟气发生反应,ABC正确;
(2)根据核磁共振氢谱图,可知该物质中含有一种类型的氢原子,具有完全对称结构,其结构简式为:![]()
(3)电解乙醇(![]() )和氢氧化钠(
)和氢氧化钠(![]() )制取乙醇钠(
)制取乙醇钠(![]() ),电解时阳极是氢氧根离子失电子发生氧化反应的过程,产生氧气,其电极反应式为:
),电解时阳极是氢氧根离子失电子发生氧化反应的过程,产生氧气,其电极反应式为:
![]() ,阴极上是乙醇中的羟基氢原子得电子的还原反应,即
,阴极上是乙醇中的羟基氢原子得电子的还原反应,即
![]() 。
。

【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=_________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)为加快反应速率,可以采取的措施是_______
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3
【题目】CO、SO2是大气污染气体,利用化学反应是治理污染的重要方法。
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇:CO+2H2![]() CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。

(1)下列能说明反应达到平衡状态的是_______(填序号)。
①v逆(CO)=2v正(H2)
②c(CO)=c(CH3OH)
③混合气体的平均相对分子质量不变
④单位时间内生成2n mol H2的同时生成n mol CH3OH
(2)该反应在A点的平衡常数K_________(用a和V表示)。
(3)写出既能增大v(CO)又能提高CO转化率的一项措施:________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图(如图1所示),写出该电池正极的电极反应式_______。

(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸(原理如图2所示)。写出开始电解时阳极的电极反应式_______。
Ⅲ.硫代硫酸钠(Na2S2O3)俗称大苏打,有着广泛的用途。用SO2可制Na2S2O3。某小组同学制备、预测并探究硫代硫酸钠的性质(反应均在溶液中进行)。
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | 把pH试纸放在玻璃片上,用玻璃棒蘸取溶液滴在试纸上 | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 黄绿色颜色变浅,甚至褪去 |
(6)分析SO2能制备Na2S2O3的理论依据是_________。
(7)用离子方程式表示Na2S2O3溶液具有碱性的原因_________。
(8)探究2反应的离子方程式为_________。