题目内容
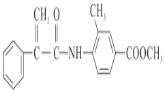
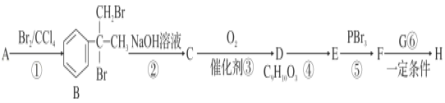
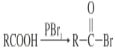
【题目】(1)在下列反应中,HCl作还原剂的是________,HCl作氧化剂的是________。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) ![]() PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) ![]() KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(2)用“双线桥法”标明以下反应中电子转移的方向和数目________,若反应中有3.01×1023个电子转移,则被氧化的还原剂的物质的量为___________。2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
【答案】③④ ② 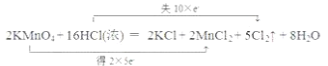 0.5mol
0.5mol
【解析】
根据氧化还原反应中元素化合价的变化判断氧化剂和还原剂;用双线桥法表示电子的转移方向及数目。
(1)①CaCO3+2HCl=CaCl2+CO2↑+H2O反应中,HCl中Cl元素和H元素化合价没有变化,所以既不是氧化剂也不是还原剂;
②Fe+2HCl=FeCl2+H2↑反应中,HCl中Cl元素化合价没有变化,H元素化合价由+1降低为0,得电子,被还原,HCl作氧化剂;
③PbO2+4HCl(浓) ![]() PbCl2+Cl2↑+2H2O反应中,HCl中Cl元素化合价由-1升高为0,失电子,被氧化,HCl作还原剂;
PbCl2+Cl2↑+2H2O反应中,HCl中Cl元素化合价由-1升高为0,失电子,被氧化,HCl作还原剂;
④KClO3+6HCl(浓) ![]() KCl+3Cl2↑+3H2O反应中,HCl中Cl元素化合价由-1升高为0,失电子,被氧化,HCl作还原剂;
KCl+3Cl2↑+3H2O反应中,HCl中Cl元素化合价由-1升高为0,失电子,被氧化,HCl作还原剂;
⑤CuO+2HCl=CuCl2+H2O反应中,HCl中Cl元素和H元素化合价都没有变化,所以既不是氧化剂也不是还原剂,故答案为:③④; ②;
(2)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,得电子,Cl元素化合价升高,失电子,根据得失电子守恒用双线桥法表示为: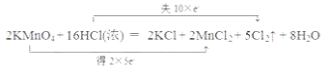 ;反应中HCl为还原剂,被氧化,转移10mol电子有10molHCl被氧化,
;反应中HCl为还原剂,被氧化,转移10mol电子有10molHCl被氧化,![]() ,则n(HCl)=0.5mol,故答案为:
,则n(HCl)=0.5mol,故答案为: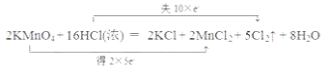 ; 0.5mol。
; 0.5mol。

 小学期末标准试卷系列答案
小学期末标准试卷系列答案