题目内容
5.可逆反应A(g)+3B(g)?2C (g),取2mol/L A和5mol/L B置于一个5L的密闭容器中,2min后达到平衡状态,测得容器A内的浓度为1.6mol/L.(1)这2min内B和C的平均反应速率分别是多少?
(2)平衡时容器内C的物质的量的浓度是多少?
(3)平衡混合气体的总物质的量是多少?
(4)反应物B的平衡转化率是多少?
分析 (1)平衡时参加反应的△c(A)=(2-1.6)mol/L=0.4mol/L,则$\overline{v}(A)$=$\frac{△c}{△t}$=$\frac{0.4mol/L}{2min}$=0.2mol/(L.min),同一可逆反应同一时间内各物质的反应速率之比等于其计量数之比,据此计算B、C的平均反应速率;
(2)同一可逆反应同一时间内参加反应的各物质浓度之比等于计量数之比,据此计算平衡时容器内C物质的量的物质的量浓度;
(3)应初始A的物质的量=2mol/L×5L=10mol、B的物质的量=5mol/L×5L=25mol,
参加反应的A的物质的量=(2-1.6)mol/L×5L=2mol,根据方程式知,该反应的反应前后气体的计量数增加2,根据参加反应A的物质的量与反应体系增加的物质的量之间的关系式计算增加的物质的量,从而计算平衡混合气体的总物质的量;
(4)根据方程式知,参加反应的A、B物质的量之比=1:3,则参加反应的B的物质的量=2mol×3=6mol,反应初始B的物质的量=5mol/L×5L=25mol,据此计算转化率.
解答 解:(1)平衡时参加反应的△c(A)=(2-1.6)mol/L=0.4mol/L,则$\overline{v}(A)$=$\frac{△c}{△t}$=$\frac{0.4mol/L}{2min}$=0.2mol/(L.min),同一可逆反应同一时间内各物质的反应速率之比等于其计量数之比,
则B的平均反应速率=3$\overline{v}(A)$=3×0.2mol/(L.min)=0.6mol/(L.min),
C的平均反应速率=2$\overline{v}(A)$=2×0.2mol/(L.min)=0.4mol/(L.min),
答:这2min内B、C的平均反应速率分别是0.6mol/(L.min)、0.4mol/(L.min);
(2)同一可逆反应同一时间内参加反应的各物质浓度之比等于计量数之比,衡时参加反应的△c(A)=(2-1.6)mol/L=0.4mol/L,参加反应的A、C的物质的量浓度之比为1:2,所以平衡时容器内C物质的量浓度=2△c(A)=2×0.4mol/L=0.8mol/L,
答:平衡时容器内C的物质的量的浓度是0.8mol/L;
(3)反应初始A的物质的量=2mol/L×5L=10mol、B的物质的量=5mol/L×5L=25mol,
参加反应的A的物质的量=(2-1.6)mol/L×5L=2mol,根据方程式知,该反应的反应前后气体的计量数减少2,
设反应后气体减少的物质的量为xmol,
A(g)+3B(g)?2C (g)减少
1mol 2mol
2mol x
1mol:2mol=2mol:x
x=$\frac{2mol×2mol}{1}$=4mol,
则反应后混合气体总物质的量=10mol+25mol-4mol=31mol,
答:平衡混合气体的总物质的量为31mol;
(4)参加反应的A的物质的量=(2-1.6)mol/L×5L=2mol,根据方程式知,参加反应的A、B物质的量之比=1:3,则参加反应的B的物质的量=2mol×3=6mol,反应初始B的物质的量=5mol/L×5L=25mol,其转化率=$\frac{6mol}{25mol}×100%$=24%,
答:B的转化率为24%.
点评 本题考查化学平衡有关计算,侧重考查学生分析计算能力,利用三段式法结合各物质的关系式解答即可,题目难度不大.

| A. | 金刚石和石墨 | B. | 水晶和石英 | C. | 红磷和白磷 | D. | C60和金刚石 |
| A. | ③⑤⑧ | B. | ④⑤⑦ | C. | ④⑤⑧ | D. | ⑤⑦⑧ |
| A. | 1种 | B. | 3种 | C. | 6种 | D. | 8种 |
①氘和氚是质量数不同、质子数相同的氢的两种元素
②氢元素是指1H
③1H、2H、3H是氢的三种同位素,是同一种元素的三种原子
④1H和2H的化学性质几乎完全相同
⑤H2、D2、T2的摩尔质量相等.
| A. | ②③ | B. | ③④ | C. | ①③④⑤ | D. | ②③④⑤ |
| A. | H、D、T表示三种氢原子 | |
| B. | 卤族元素最高化合价均为正7价,最低化合价均为负1价 | |
| C. | 金属元素的原子最外层电子数,都少于4个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
| A. | 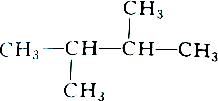 和 和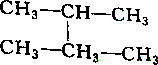 | B. | 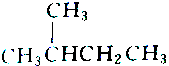 和 和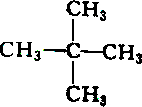 | ||
| C. | 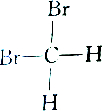 和 和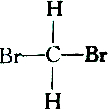 | D. | 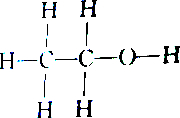 和 和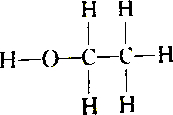 |
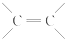 结构的有机物可被高锰酸钾溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,现以甲基丙烯(
结构的有机物可被高锰酸钾溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,现以甲基丙烯(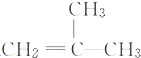 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.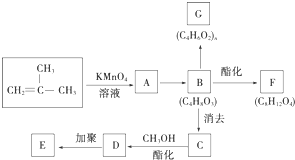
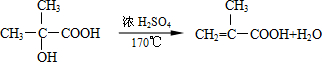 B→G的反应类型:缩聚,G的结构简式:
B→G的反应类型:缩聚,G的结构简式: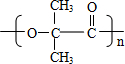 .
.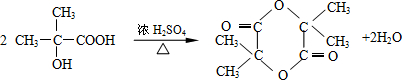 ,两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为
,两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为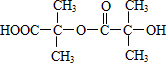 .
.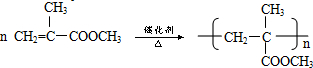 .
.