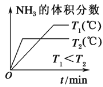
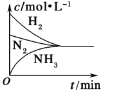
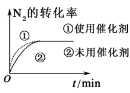
题目内容
【题目】有下列物质的溶液:①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小比较为____________(用序号表示,下同)。
(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为___________,经测定溶液中c(CH3COO-)为1.4×10-3 mol/L,此温度下醋酸的电离常数Ka=____________,温度升高,Ka将_____(填“变大”“不变”或“变小”,下同),加入少量CH3COONa后c(H+)______,Ka______。
【答案】③>②=④>① 0.1mol/L 1.99×10-5 变大 变小 不变
【解析】
(1)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸;
(2)n(CH3COOH)=![]() =0.1mol,根据c=
=0.1mol,根据c=![]() 计算物质的量浓度;根据k=
计算物质的量浓度;根据k=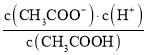 计算其大小并判断升温电离平衡常数的变化,结合外界条件对弱电解质的电离平衡的影响判断离子浓度的变化,电离平衡常数只受温度影响。
计算其大小并判断升温电离平衡常数的变化,结合外界条件对弱电解质的电离平衡的影响判断离子浓度的变化,电离平衡常数只受温度影响。
(1)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,若①CH3COOH ②HCl③H2SO4 ④NaHSO4溶液的物质的量浓度相同,c(H+)的大小顺序为:③>②=④>①;
(2)n(CH3COOH)=![]() =0.1mol,c(CH3COOH)=
=0.1mol,c(CH3COOH)=![]() =0.1mol/L;
=0.1mol/L;
c(CH3COO-)=c(H+)=1.4×10-3mol/L,k=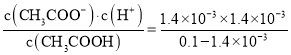 =1.99×10-5;醋酸电离吸热,升温促进电离,电离平衡常数增大;向醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小,温度不变电离平衡醋酸不变。
=1.99×10-5;醋酸电离吸热,升温促进电离,电离平衡常数增大;向醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小,温度不变电离平衡醋酸不变。

【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D