��Ŀ����
����Ŀ���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ������β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)��
2CO2(g)+N2(g)��
��1������һ���¶��£���1.0molNO��0.5molCO����0.5L�̶��ݻ��������У��ﵽƽ��ʱNO��CO��CO2��N2���ʵ����ֱ�Ϊ��0.8mol��0.3mol��0.2mol��0.1mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ���������¶Ȳ��䣬���������г���CO��N2��0.3mol��ƽ�⽫ �ƶ�������������ҡ���������
��2��CO���Ժϳɼ״�����֪��
��2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ��H=��1529kJ��mol��1��
��2CO(g)+O2(g)=2CO2(g) ��H=��566.0kJ��mol��1��
��2H2(g)+O2(g)=2H2O(l) ��H=��571.6kJ��mol��1��
��CO(g)+2H2(g)![]() CH3OH(g) ��H= kJ��mol��1��
CH3OH(g) ��H= kJ��mol��1��
���𰸡���1��K=5/144��0.0347 ����2����90.1
��������
�����������1�����������Ϊ0.5L��ƽ��ʱNO��CO��CO2��N2���ʵ����ֱ�Ϊ��0.8mol��0.3mol��0.2mol��0.1mol����÷�Ӧ�Ļ�ѧƽ�ⳣ��K=��0.4��0.4��0.2���£�1.6��1.6��0.6��0.6��=0.0347��Q=��0.4��0.4��0.8���£�1.6��1.6��1.2��1.2��=0.0347��ƽ�ⲻ�ƶ���
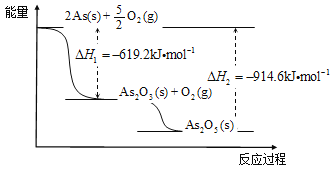
��2�����ݸ�˹���ɣ��ڡ�1/2+��-�١�1/2����H=-566.0/2-571.6+1529/2=��90.1 kJ��mol��1��

����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ������Ҫ������
��1����֪��Ӧ2H2+O2 =2H2OΪ���ȷ�Ӧ����ͼ����ȷ��ʾ�÷�Ӧ�������仯���� ��

��ѧ�� | H��H | O��O | H��O |
����kJ/mol | 436 | 496 | 463 |
�Ӷϼ��ͳɼ��ĽǶȷ���������Ӧ�������ı仯����ѧ���ļ�����������������1molˮ���Էų�����____________kJ
��2��ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���������ͬ��ͭ����п���õ������Ӻ����CuSO4��Һ�У���Ƴ�ԭ��أ����������� , �����ķ�ӦʽΪ ���������Һ��SO42�� ���� �����������������һ��ʱ���ȡ��ϴ�����������������������Ϊ12.9 g��������ͨ���ĵ��ӵ����ʵ����� mol��
��3��һ���¶��£���3 molA�����1mol B����ͨ��һ�ݻ��̶�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ ��XΪ ������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ�� 0.8mol/L������ڣ�С�ڻ���ڡ�����
xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ ��XΪ ������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ�� 0.8mol/L������ڣ�С�ڻ���ڡ�����