题目内容
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为![]() ,则其在周期表中的位置是_____________。
,则其在周期表中的位置是_____________。
(2)N元素非金属性比As强,下列说法正确的是_______。
①NH3的热稳定性比AsH3差
②HNO3的酸性比H3AsO4强
③N的原子半径比As的原子半径小
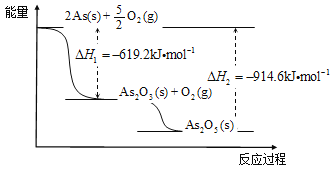
(3)根据下图写出As2O5分解为As2O3的热化学方程式____________________。
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:
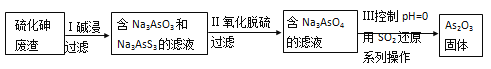
① As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应________(选填“是”或“不是”)氧化还原反应。
②过滤操作所用的玻璃仪器有_________________________。
③写出过程Ⅲ的离子方程式_________________。
【答案】(1)第四周期,VA族(1分)
(2)②③(2分)
(3)As2O5(s)=As2O3(s)+O2(g) ΔH="+295.4kJ" ·mol-1(2分)
(4)①不是(1分)
②漏斗、烧杯、玻璃棒(2分)
③2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O。(2分)
【解析】试题分析:(1)As的原子有4个电子层,最外层有5个电子,则其在周期表中的位置是第四周期,VA族。
(2)元素的非金属性强弱比较可通过比较单质与氢化合的难易及生成氢化物的稳定性、最高价氧化物水化物的酸性进行比较,与原子半径大小无必然联系,选②③。
(3)根据图示知As2O5分解为As2O3的热化学方程式为As2O5(s)=As2O3(s)+O2(g) ΔH="+295.4kJ" ·mol-1。
(4)① As2S3、Na3AsS3中的S均为-2价,As2S3、Na3AsS3和Na3AsO3中As均为+3价,碱浸过程中没有元素化合价变化,发生的反应不是氧化还原反应。②过滤操作所用的玻璃仪器有烧杯、漏斗、玻璃棒。③过程Ⅲ酸性条件下AsO43-被还原为As2O3,SO2被氧化为SO42—,利用化合价升降法配平,该反应的离子方程式为2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O。

【题目】根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去)。
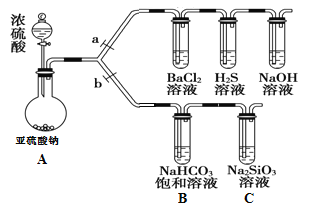
(1)验证SO2的氧化性、还原性和酸性氧化物的通性。
①连接仪器、_______________、加药品后,打开a、关闭b,然后滴入浓硫酸。
②装置A中发生的化学方程式是____________ ___。
③验证SO2的氧化性的实验现象是_____________ __。
④BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
滴加的溶液 | 氨水 | 氯水 |
沉淀的化学式 |
(2)验证碳、硅非金属性的相对强弱。
①在(1)①操作后打开b,关闭a。
②NaHCO3饱和溶液中发生的离子反应方程式为____________ ___。
③实验过程中,C中出现白色沉淀。甲同学认为不能由此说明碳的非金属性比硅强,需增加一个实验装置才能获得可靠实验结论,其改进方法为__________ 。